Questões de Concurso
Sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 404 questões
A equação  descreve a reação entre dois
gases cuja avaliação é mencionada na tabela que se segue.
descreve a reação entre dois
gases cuja avaliação é mencionada na tabela que se segue.
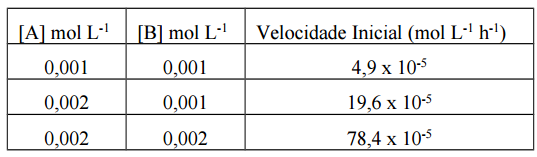
De acordo com os dados apresentados, a constante de
velocidade nessa reação, em mol-3 L3
h-1, é:
A figura a seguir, adaptada da revista Quim. Nova, v. 38, 1265-1272, 2015, representa o processo de degradação fotocalítica do azul de metileno obtida com uma amostra de CaFe em diferentes condições.
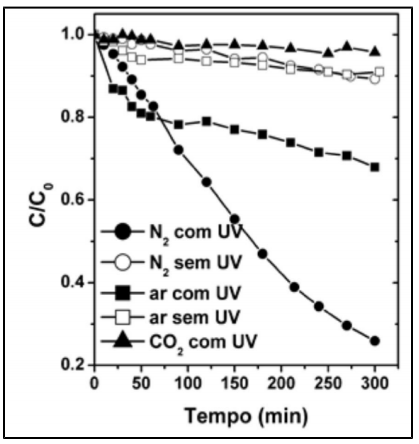
Com base nessa figura, a condição na qual a velocidade inicial
é maior é:
Com base nos conceitos de equilíbrio químico, julgue o item subsequente.
Pelo princípio de Le Chatelier, quando uma força é
aplicada a um sistema em equilíbrio dinâmico, o
equilíbrio tende a se ajustar para minimizar o efeito da
força. Um exemplo disso seria o fato de que uma reação
no equilíbrio tende a seguir em uma reação endotérmica
quando se aumenta a temperatura.
Com base nos conceitos de equilíbrio químico, julgue o item subsequente.
O equilíbrio químico ocorre quando há um equilíbrio
dinâmico entre reagentes e produtos em uma reação
química, ou seja, a condição na qual os processos direto
e inverso ocorrem simultaneamente em velocidades
iguais.
Acerca da termoquímica, da espontaneidade de reações e da ação de catalisadores, julgue o item a seguir.
Um catalisador é uma substância que aumenta a
velocidade de uma reação sem ser consumida durante
ela. Um catalisador é homogêneo se está presente em
uma fase diferente da dos reagentes e é heterogêneo se
está presente na mesma fase dos reagentes.
Considerando os conceitos de átomo, estados da matéria e reações químicas, julgue o item seguinte.
As reações químicas podem ser reversíveis ou irreversíveis; como exemplo de uma transformação reversível, tem-se a solubilização de comprimidos efervescentes em água com formação de bolhas.2 H₂ + 2 NO → N₂ + 2 H₂O
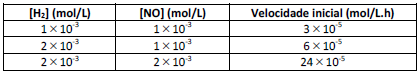
Marque a alternativa que apresenta a lei de velocidade que concorda com os dados experimentais.
( ) Quanto maior for a concentração dos reagentes, maior será a velocidade de reação. ( ) Colisões efetivas nem sempre levam à formação de novos produtos. ( ) Quanto maior a energia de ativação, mais rápida será a reação. ( ) Quanto maior a temperatura, maior será a velocidade de uma reação.
Assinale a sequência correta.
A química é uma ciência que explica o mundo macroscópico por meio de modelos microscópicos com uma linguagem própria que representa as substâncias e suas transformações. A esse respeito, julgue o item a seguir.
Os catalisadores diminuem a quantidade de energia liberada ou
consumida nas reações químicas.
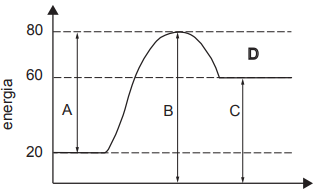
caminho da reação
Em relação a essa reação, é CORRETO afirmar que
( ) Catalizadores são substâncias que, quando participam da reação, são consumidas e podem ser classificados como homogêneos ou heterogêneas. ( ) A ordem de reação é sempre determinada pelos coeficientes estequiométricos da reação. ( ) A velocidade de uma reação de ordem zero é independente da concentração do reagente. ( ) O tempo de meia-vida de uma substância numa reação química é o tempo necessário para que sua concentração se reduza à metade da inicial. ( ) A constante de equilíbrio de uma reação química é adimensional e seu valor numérico depende da temperatura.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
Atenção: Considere as informações abaixo para responder a questão.
A síntese de Haber-Bosch é o método industrial para a produção de amônia utilizada na fabricação de fertilizantes e de muitos outros compostos.
A equação global de reação é dada por:
N2(g) + 3H2(g) ⇋ 2NH3(g) ΔH = −92,22 kcal . mol−1
A tabela abaixo mostra os dados experimentais da reação de síntese da amônia realizada a temperatura e pressão constantes.

A reação de cloro gasoso com uma base forte pode ser descrita pela equação
Cℓ2(g) + 2 NaOH(aq) → NaCℓ(aq) + NaOCℓ(aq) + H2O(ℓ)
Para o posterior preparo de 0,5 litro de solução 0,2 mol.L–1 de hipoclorito de sódio obtido por meio desse processo, a massa de hidróxido de sódio que deve reagir em presença de excesso de cloro gasoso é, no mínimo, igual a
Dados: Massas molares H = 1g.mol–1 ; O = 16g.mol–1 Na = 23g.mol–1
O cloreto de titânio(IV), TiCl4, é um importante produto químico industrial. Esse pode ser usado tanto na obtenção do TiO2 quanto de titânio metálico. O TiCl4 pode ser obtido a partir de um minério contendo titânio (TiO2 impuro), utilizado em excesso, com carbono e gás cloro, conforme a equação química a seguir.
TiO2(s) + 2 Cl2(g) + C(s) → TiCl4(l) + CO2(g)
Considere que a obtenção do TiCl4 seja feita a partir de 852 g de C e 852 g de Cl2.
Dados: Cl2 (71 g mol-1 ); C (12 g mol-1 ) e TiCl4 (190 g mol-1 )
O reagente limitante e a massa em gramas de TiCl4 obtida são, respectivamente:
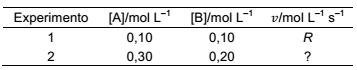
Existem muitos motivos para estudar a velocidade de uma reação, do ponto de vista prático, o conhecimento das velocidades de reações é útil na concepção de medicamentos, no controle da poluição e no processamento de alimentos, bem como nas aplicações de setores produtivos em geral. Então para exemplificar, considere que a velocidade de uma reação entre os compostos A e B segue a lei de velocidade, v = k [A] 2 [B] . Com base nos dados da tabela abaixo, determine a velocidade do Experimento 2 observada a mesma temperatura do Experimento 1.
A palavra cinética, no caso da Química, refere-se à velocidade de uma reação, isto é, à variação da concentração de desaparecimento de um reagente ou de surgimento de um produto com o tempo. Para exemplificar, considere que a 280 °C, o dióxido de nitrogênio se decompõe no óxido nítrico e oxigênio:
2NO2(g) → 2NO(g) + O2(g)
E que em um experimento, a concentração de NO2 diminui de 0,010 mol L–1 a 0,005 mol L–1 no período de 100 s. Qual é a velocidade média de desaparecimento de NO2?
O processo Haber-Bosch é utilizado industrialmente para a produção de amônia. A quantidade de NH3 produzida na reação entre N2 e H2 é influenciada, entre outros fatores, por pressão e temperatura. A produção da amônia pode ser representada pela equação química a seguir:

O gráfico 1 representa a variação de porcentagem de amônia produzida em reações realizadas a diferentes temperaturas, à pressão de 500 atm.
O quadro 1 apresenta quatro diferentes condições de reação testadas, variando-se a temperatura e as quantidades dos gases reagentes. Considere que o gás apresentado no quadro seja o reagente limitante na condição em questão.

Uma certa reação química em fase gasosa é representada pela equação abaixo. Sabe-se que o reagente B e C não influi na velocidade da reação, mas o A quando elevado ao quadrado, altera a velocidade quadruplicada. Deste modo, assinale a alternativa que fornece a equação da velocidade CORRETA.
2A + 2 B → C
NH3 + H2SO4 → (NH4)2SO4
Se a obtenção deste sal for obtida através da lavagem do gás amônia com uma solução de ácido sulfúrico, dado que a concentração de amônia é de 34.000 mg/L, qual seria a concentração de ácido sulfúrico em mol/L necessária para se obter 100% de rendimento? (Dados: massas molares: H= 1,0 g/mol, N= 14 g/mol, O= 16 g/mol, S= 32 g/mol)