Questões de Concurso
Sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 402 questões
De acordo com os dados da tabela abaixo de velocidade para a reação dos íons amônio e nitrito em água a 25ºC:
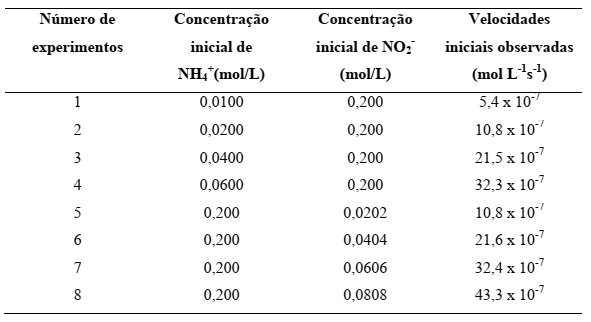
Podemos afirmar que a velocidade para [NH4
+
] = 0,100 mol/L e [NO2
-
] = 0,100 mol/L em mol
L
-1
s
-1
é:
Brometo de nitrosila é um gás vermelho que pode ser obtido pela reação do óxido nítrico com bromo molecular, de acordo com a seguinte equação química:
NO(g) + ½ Br2(g) → NOBr(g)
Resultados cinéticos da síntese desse gás estão representados na tabela a seguir:
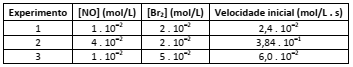
O valor da constante de velocidade da reação de obtenção do brometo de nitrosila, em L2
/mol2 . s, é igual a
Ao serem adicionadas em água, substâncias que formam os tabletes efervescentes se dissolvem e reagem provocando a evolução de gás carbônico, que procede com diferentes velocidades, dependendo da quantidade de matéria e de como os reagentes entram em contato entre si, quando se joga o tablete na água. Considerem-se os componentes nas situações abaixo:
I - Um tablete inteiro
II - Dois tabletes inteiros
III - Dois tabletes macerados na forma de pó
Seria esperada a seguinte ordem crescente de velocidade inicial, v(situação), de evolução de gás ao ser cada um jogado em um copo de água:
Na reação de zinco metálico (Zn(s)) com ácido clorídrico (HCl(aq)), há formação de cloreto de
zinco (ZnCl2(aq)) e gás hidrogênio (H2(g)), conforme a seguinte equação:
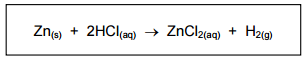
Nessa reação, o HCl é consumido e a tabela a seguir mostra a sua concentração em função do tempo.
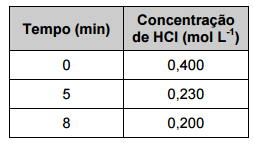
A alternativa que apresenta o valor correto da velocidade média da reação (mol L-1 min-1
) no intervalo de 5 a
8 minutos é
• dobrando a concentração de A, a velocidade de formação de C duplica; e
• dobrando a concentração de B, a velocidade de reação de C quadruplica.
Com base nessas informações,
Uma reação de grande importância do propeno é a hidroformilação: o propeno reage com o chamado gás de síntese — uma mistura de CO(g) e H2(g) — para gerar aldeídos, conforme mostra o esquema seguinte.

O interesse industrial pelas reações de hidroformilação advém do fato de os aldeídos resultantes dessas reações serem compostos muito versáteis, usados como matéria-prima para a preparação de diversos outros compostos. Por exemplo, o butanal pode ser usado na síntese do composto 1, conforme indicado no esquema a seguir.

Além disso, a depender das condições reacionais e do catalisador empregado, reações consecutivas podem suceder a hidroformilação, produzindo diretamente outros compostos, conforme exemplificado no seguinte esquema.

A respeito dos compostos e das reações apresentados, julgue o próximo item.
O H2 é um gás inodoro, explosivo, que pode ser produzido a
partir da reforma catalítica do metano ou da hidrólise da água.
[A] (M) [B] (M) velocidade inicial (m/s)
2,16 0,525 8,05 × 10-3
2,16 1,05 3,22 × 10-2
4,33 0,525 4,03 × 10-3
velocidade = k · [A]m · [B]n
Considerando a reação química geral aA + bB → produtos e as velocidades iniciais, as molaridades e a lei de velocidade mostradas na tabela acima, julgue o item subsequente.
O valor de k é maior que 5,5 × 10-2 s-1.
[A] (M) [B] (M) velocidade inicial (m/s)
2,16 0,525 8,05 × 10-3
2,16 1,05 3,22 × 10-2
4,33 0,525 4,03 × 10-3
velocidade = k · [A]m · [B]n
Considerando a reação química geral aA + bB → produtos e as velocidades iniciais, as molaridades e a lei de velocidade mostradas na tabela acima, julgue o item subsequente.
Os valores de m e n são 2 e -1, respectivamente.
[A] (M) [B] (M) velocidade inicial (m/s)
2,16 0,525 8,05 × 10-3
2,16 1,05 3,22 × 10-2
4,33 0,525 4,03 × 10-3
velocidade = k · [A]m · [B]n
Considerando a reação química geral aA + bB → produtos e as velocidades iniciais, as molaridades e a lei de velocidade mostradas na tabela acima, julgue o item subsequente.
Para a reação de segunda ordem aA + bB → produtos umgráfico de ln [A] versus o tempo é representado por uma reta.
Um dos objetivos principais da cinética química é a determinação das leis da velocidade, isto é, expressões matemáticas simples que informam com que rapidez uma reação química ocorre. Leis de velocidade com formas matemáticas semelhantes pressupõem que as reações que elas representam se comportam de uma mesma maneira, à medida que a reação ocorre. Com relação a esse assunto,julgue o próximo item.
A velocidade de uma reação química indica quantos mols de um reagente estão reagindo ou quantos mols de um produto estão sendo formados durante certo período.
Um dos objetivos principais da cinética química é a determinação das leis da velocidade, isto é, expressões matemáticas simples que informam com que rapidez uma reação química ocorre. Leis de velocidade com formas matemáticas semelhantes pressupõem que as reações que elas representam se comportam de uma mesma maneira, à medida que a reação ocorre. Com relação a esse assunto,julgue o próximo item.
Se a reação química — H2 + O2 → H2O — ocorre a uma velocidade igual a -6 mol/min em relação a H2, é correto afirmar que a velocidade em relação a O2 é igual a -3 mol/min.
A Bioluminescência é a denominação de um fenômeno de quimioluminescência onde a reação química é realizada em um organismo, como o vaga-lume, por exemplo. A reação química converte 90 a 96% da energia em luz, e somente de 4 a 10% é convertida em calor, o inverso de uma lâmpada comum.

Pode-se inferir que
A água oxigenada, nomenclatura comercialmente conhecida, trata-se de uma solução aquosa de peróxido de hidrogênio (H2O2); que no comércio é encontrada geralmente em uma solução a 3%. Quando pura, é um líquido viscoso, de densidade 1,46 g/mL, incolor e de cheiro semelhante ao do ácido nítrico.Sua decomposição pode ser representada pela reação global: 2 H2O2 (aq) → 2 H2O (l) + O2 (g)
Esta reação ocorre em duas etapas, descritas a seguir:
Etapa 1 (lenta) H2O2 + I- → H2O + IO-
Etapa 2 (rápida) H2O2 + IO- → H2O + O2 + I-
Indique a alternativa que apresenta a lei de velocidade da decomposição do peróxido de hidrogênio.
A amônia (NH3) é um dos produtos químicos mais importantes para o ser humano, sendo uma das cinco substâncias produzidas em maior quantidade no mundo, sendo utilizada como fertilizantes, produção de plásticos e explosivos. A equação abaixo mostra a reação de obtenção da amônia. Considerando o Princípio de Le Chatelier, identifique uma dascondições necessárias que desfavorece a produção de grandes quantidades de amônia.
N2(g) + 3 H2(g) → 2NH3(g) ∆H= - 92,22 KJ