Questões de Concurso
Sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 404 questões
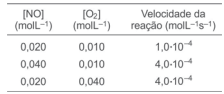
Utilizando-se de experimentos bastante elaborados, os químicos têm investigado o percurso das reações químicas, com o objetivo de determinar a expressão da lei da velocidade e verificar se essas reações são elementares ou não elementares. A tabela apresenta as concentrações colhidas durante três experimentos envolvendo a reação do monóxido de nitrogênio, NO(g), com o oxigênio, O2(g), na obtenção de dióxido de nitrogênio, NO2(g), à determinada temperatura.
A partir da análise dos dados da tabela e das informações
do texto, é correto afirmar que a
I. acelera a reação, mas não altera a composição química dos reagentes e produtos envolvidos. II. não altera a quantidade de substância produzida na reação. III. não altera a variação de entalpia. É correto o que está contido em
O ozônio pode ser convertido em oxigênio por meio de sua reação com dióxido de nitrogênio, de acordo com a equação química abaixo.
NO2(g) + O3(g) → NO3(g) + O2(g)
Com o intuito de estudar a cinética da reação, três experimentos foram realizados, tendo sido obtidos os seguintes resultados:

A partir das informações e dos dados apresentados acima e dos conceitos usados em cinética química, julgue o item subsecutivo.
A lei da velocidade para essa reação pode ser expressa por:
v = 5,47×104
[NO2][O3].
O ozônio pode ser convertido em oxigênio por meio de sua reação com dióxido de nitrogênio, de acordo com a equação química abaixo.
NO2(g) + O3(g) → NO3(g) + O2(g)
Com o intuito de estudar a cinética da reação, três experimentos foram realizados, tendo sido obtidos os seguintes resultados:

A partir das informações e dos dados apresentados acima e dos conceitos usados em cinética química, julgue o item subsecutivo.
As ordens da reação para O3 e NO2 são, respectivamente, 2 e 1.
O ozônio pode ser convertido em oxigênio por meio de sua reação com dióxido de nitrogênio, de acordo com a equação química abaixo.
NO2(g) + O3(g) → NO3(g) + O2(g)
Com o intuito de estudar a cinética da reação, três experimentos foram realizados, tendo sido obtidos os seguintes resultados:

A partir das informações e dos dados apresentados acima e dos conceitos usados em cinética química, julgue o item subsecutivo.
Em uma reação de ordem zero, a constante de velocidade dessa
reação não depende da concentração dos reagentes, sendo
constante durante toda a reação. Nessas reações, a
concentração dos reagentes diminui linearmente em função do
tempo.
O ozônio pode ser convertido em oxigênio por meio de sua reação com dióxido de nitrogênio, de acordo com a equação química abaixo.
NO2(g) + O3(g) → NO3(g) + O2(g)
Com o intuito de estudar a cinética da reação, três experimentos foram realizados, tendo sido obtidos os seguintes resultados:

A partir das informações e dos dados apresentados acima e dos conceitos usados em cinética química, julgue o item subsecutivo.
A velocidade de consumo de O3 é o dobro da velocidade de
consumo de NO2 e igual à velocidade de produção de O2.
Na nitração mostrada na reação acima, são adicionados 5 moles de benzeno e 6 moles de ácido nítrico.
Após 1 hora de reação, obtém-se uma conversão de 60%.
O número de moles de reagente limitante que resta na reação e a massa, em gramas, formada de produto são, respectivamente,
Dados:
Massa Atômica do Carbono = 12
Massa Atômica do Oxigênio = 16
Massa Atômica do Nitrogênio = 14
Massa Atômica do Hidrogênio = 1
Nesse processo, normalmente, o agente limitante e o reagente em excesso são, respectivamente,
Al2 O3 + 2 NaOH → 2 NaAlO2 + H2O
Se a bauxita a ser tratada tem 50% (m/m) de óxido de alumínio e a quantidade a ser tratada é 1.020 toneladas, quantas toneladas de solução de soda cáustica devem ser utilizadas?
Dados:
Massa Atômica do Alumínio = 27
Massa Atômica do Sódio = 23
Massa Atômica do Hidrogênio = 1
Massa Atômica do Oxigênio = 16
Densidade da Água = 1,0 kg/L
No entanto, se, em uma certa temperatura constante, esse processo alcança uma situação de equilíbrio, e o valor de constante de equilíbrio, “K”, é igual a 1, a quantidade de reagente no equilíbrio é
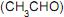 , à temperatura ambiente, foi determinada experimentalmente por um técnico em química, e os dados encontrados estão sumarizados na tabela.
, à temperatura ambiente, foi determinada experimentalmente por um técnico em química, e os dados encontrados estão sumarizados na tabela.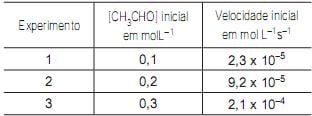
A constante de velocidade de decomposição do etanal é:
Fe3O4(s)+ 4 H2(g)↔ 3 Fe(s)+ 4 H2(g) ΔH = -209,5 kcal.mol -1
e considerando as afirmações seguintes,
I. A adição de um catalisador desloca o equilíbrio para direita.
II. O aumento da pressão desloca o equilíbrio para a esquerda.
III. A diminuição da temperatura desloca o equilíbrio para a direita.
IV. A diminuição da pressão desloca o equilíbrio para a direita.
V. O aumento da temperatura desloca o equilíbrio para a esquerda.
verifica-se que está(ão) correta(s)

É(São) correta(s) apenas a(s) assertativa(s)
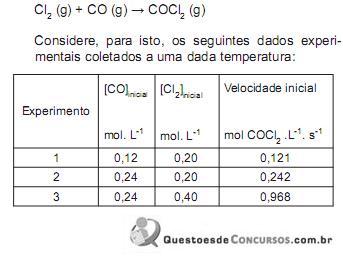
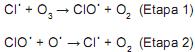
Em relação à atuação do catalisador e o mecanismo acima, julgue os itens a seguir.

É(São) correta(s) a(s) assertiva(s)
 2 NO2 (g), as concentrações das espécies reagentes influenciam na velocidade de reação.
2 NO2 (g), as concentrações das espécies reagentes influenciam na velocidade de reação. A expressão algébrica da relação entre essas concentrações e a velocidade é representada pela equação de velocidade de reação dada por


