Questões de Concurso
Sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 402 questões
A partir das informações do texto, é correto concluir que a reação AgCL(s) → Ag(s) + ½ CL2(g) é catalisada por luz ultravioleta.
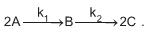 A reação ocorre em um tanque que opera a temperatura constante. Sendo
A reação ocorre em um tanque que opera a temperatura constante. Sendo 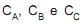 as concentrações das espécies A, B e C, respectivamente
as concentrações das espécies A, B e C, respectivamente 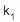 a velocidade específica de decomposição do reagente A, e
a velocidade específica de decomposição do reagente A, e 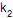 a velocidade específica de decomposição do intermediário B, a taxa de formação do produto C é dada por
a velocidade específica de decomposição do intermediário B, a taxa de formação do produto C é dada por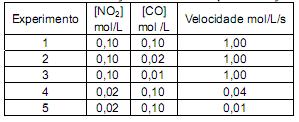
Ao se tratar de velocidades de reação, é importante saber não só a velocidade com que os reagentes são transformados em produtos, mas também a sequência de processos físicos e químicos pelos quais essa conversão ocorre. As velocidades de reação são estudadas para que se obtenha uma visão detalhada acerca do que as moléculas fazem umas em relação às outras quando reagem. De acordo com essa informação e considerando a tabela apresentada, assinale a alternativa correta.
Podemos afirmar que seus constituintes estarão em equilíbrio químico quando:
N2O5 (g) → 2 NO2(g) + 1/2 O2(g)
A constante de velocidade desta reação é igual a 1,38 x 10-5 s-1 a uma dada temperatura. Se a concentração inicial do N2O5 for 4,0 x 10-3 mol L-1,em quanto tempo aproximadamente a concentração cai até 1,0 x 10-3 mol L-1 ?
Dados: ln 2,5 = 0,916; ln 10-1 = -2,302
2A(g)+ 3B(g) → A2 B 3(g)
De um conjunto de experimentos foram coletados dados e estes, organizados na seguinte tabela:

Se o mesmo experimento for realizado com a hexocinase, mas na presença de quantidades saturantes de um de seus substratos, pode-se esperar o seguinte resultado:
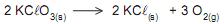
Sendo o volume molar igual 22,4 L/mol (na condição normal de temperatura e pressão), o volume máximo de oxigênio que pode ser obtido a partir da decomposição de 4,00 mol de KCLO3 , com o rendimento percentual de 90%, em L, é
Sendo k a constante de velocidade, a lei de velocidade do decaimento radioativo do carbono-14 é representada pela equação
A tabela a seguir fornece os dados cinéticos obtidos para a reação 2ICl(g) + H2(g) → I2(g) + 2 HCl(g)
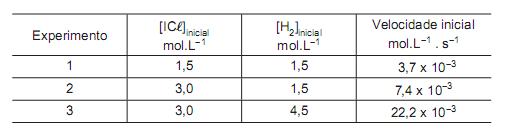
A partir dos dados experimentais obtidos, a expressão da velocidade para essa reação é
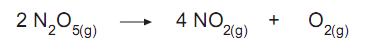
Dois experimentos foram feitos visando a obter informação sobre a cinética de reação. Os resultados das experiências estão no quadro abaixo.

A partir dos dados do quadro, conclui-se que a expressão da lei de velocidade de decomposição do
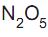 é
é
Com relação à reação em apreço e considerando-se condições em que a lei de velocidade acima apresentada é, de fato, obedecida, julgue os itens seguintes.
Para a reação apresentada,
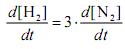 .
. 
Com relação à reação em apreço e considerando-se condições em que a lei de velocidade acima apresentada é, de fato, obedecida, julgue os itens seguintes.
A reação acima é elementar, ou seja, processa-se em uma única etapa.

Com relação à reação em apreço e considerando-se condições em que a lei de velocidade acima apresentada é, de fato, obedecida, julgue os itens seguintes.
A construção de um gráfico de ln
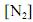 , em função de t, resulta em uma linha reta.
, em função de t, resulta em uma linha reta. 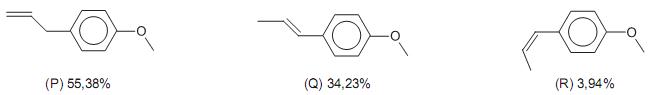
Disponível em: http://teses.icict.? ocruz.br/pdf/paulajfpm.pdf
Acesso em: 08 out. 2010. (Adaptado)
Em relação a algumas reações que podem ser realizadas com o estragol, transanetol e cisanetol, analise as afirmativas a seguir.
I - Os produtos principais da reação de hidrogenação de (P) e (Q), catalisada por platina a 25 °C e a pressão de 1 atm, são isômeros constitucionais.
II - Tanto (Q) como (R) podem descorar uma solução de
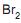 em tetracloreto de carbono com a formação de um mesmo produto principal de reação.
em tetracloreto de carbono com a formação de um mesmo produto principal de reação. III - A reação de (P) com HBr pode levar a formação de um produto de reação idêntico ao obtido na reação de (Q) com HBr.
IV - O calor liberado na reação de hidrogenação da dupla olefínica de (Q) é menor do que na de (R).
Estão corretas APENAS as afirmações
 3C(g) a 523 K, contido em um recipiente de 2 L, h 1, 2 e 4 mols dos gases A, B e C, respectivamente, no equilíbrio. Nessa situação, considerando R = 0,08 atm × L × mol -1 × K-1 e que todos os gases são ideais, os valores de KC e Kp são, respectivamente, iguais a
3C(g) a 523 K, contido em um recipiente de 2 L, h 1, 2 e 4 mols dos gases A, B e C, respectivamente, no equilíbrio. Nessa situação, considerando R = 0,08 atm × L × mol -1 × K-1 e que todos os gases são ideais, os valores de KC e Kp são, respectivamente, iguais a 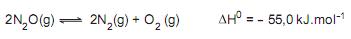
apresenta energia de ativação igual a 121 kJ.mol -1 , se ouro for empregado como catalisador e 134 kJ.mol -1 se, alternativamente, platina for empregada como catalisador. Sobre esse sistema fechado, considere as afirmativas a seguir
I – Um aumento de temperatura diminuiria o tempo para se atingir o equilíbrio e aumentaria o rendimento do processo.
II – O emprego de ouro como catalisador conduz o processo mais rapidamente ao equilíbrio, quando comparado ao emprego de platina.
III – A uma dada temperatura, o emprego dos catalisadores ao processo altera a velocidade da reação, no entanto as concentrações dos gases no equilíbrio permanecem inalteradas.
IV – Um aumento da pressão total do sistema (pela diminuição do volume) levaria a um aumento do rendimento da reação no equilíbrio.
Estão corretas APENAS as afirmativas


