Questões de Concurso
Sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 397 questões
A água oxigenada, nomenclatura comercialmente conhecida, trata-se de uma solução aquosa de peróxido de hidrogênio (H2O2); que no comércio é encontrada geralmente em uma solução a 3%. Quando pura, é um líquido viscoso, de densidade 1,46 g/mL, incolor e de cheiro semelhante ao do ácido nítrico.Sua decomposição pode ser representada pela reação global: 2 H2O2 (aq) → 2 H2O (l) + O2 (g)
Esta reação ocorre em duas etapas, descritas a seguir:
Etapa 1 (lenta) H2O2 + I- → H2O + IO-
Etapa 2 (rápida) H2O2 + IO- → H2O + O2 + I-
Indique a alternativa que apresenta a lei de velocidade da decomposição do peróxido de hidrogênio.
A amônia (NH3) é um dos produtos químicos mais importantes para o ser humano, sendo uma das cinco substâncias produzidas em maior quantidade no mundo, sendo utilizada como fertilizantes, produção de plásticos e explosivos. A equação abaixo mostra a reação de obtenção da amônia. Considerando o Princípio de Le Chatelier, identifique uma dascondições necessárias que desfavorece a produção de grandes quantidades de amônia.
N2(g) + 3 H2(g) → 2NH3(g) ∆H= - 92,22 KJ
Podemos afirmar que seus constituintes estarão em equilíbrio químico quando:
N2O5 (g) → 2 NO2(g) + 1/2 O2(g)
A constante de velocidade desta reação é igual a 1,38 x 10-5 s-1 a uma dada temperatura. Se a concentração inicial do N2O5 for 4,0 x 10-3 mol L-1,em quanto tempo aproximadamente a concentração cai até 1,0 x 10-3 mol L-1 ?
Dados: ln 2,5 = 0,916; ln 10-1 = -2,302
1ª etapa: (CH3 )3 Br → (CH 3) 3C+ + Br - (I)
2ª etapa: (CH3 )3 C+ + OH- → (CH3 )3 COH (II)
Um per?l de reação genérico (esboçado) do processo é indicado no grá?co que segue:

A energia de ativação para a reação de decomposição pode ser calculada a partir da tabela e seu valor, em kJ.mol -1 , é aproximadamente igual a:
Dados: R= 8,31 J.mol -1. k-1 , ln 4,4 = 1,48; ln 3,5 = 1,25
I. H2O(l) → H2(g) + ½ O2 (g) ΔH = +286 kJ
II. H2(g) + ½ O2 (g) → H2O(v) ΔH = –242 kJ
Assinale, a seguir, o ΔH da passagem de H2O → H2O(l).
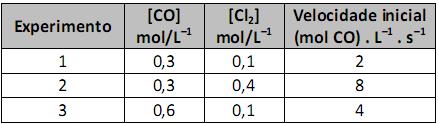
O valor da constante da velocidade, em L . mol–1 . s–1, para esse experimento é de, aproximadamente,
2 Al2 O3 (s) + 3 C → 4 Al (s) + 3 CO2 (g)
Utilizando-se 2,4 toneladas de C e sendo o rendimento da reação igual a 90%, a massa de alumínio, em toneladas, que se produz é
Dados
MAl = 27 g mol-1
MC = 12 g mol-1
O catalisador acelera a velocidade das reações porque
Nesta avaliação, diversos experimentos foram conduzidos, modificando alguns parâmetros iniciais como temperatura, concentração inicial do ácido e estado de agregação do zinco metálico.
Assinale a opção que apresenta um perfil de volume de H2 em função do tempo esperado para um par de experimentos, variando entre eles apenas um dos parâmetros.
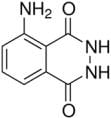
O luminol é uma substância cuja quimiluminescência é empregada em química forense para a detecção de vestígios de sangue e cuja fórmula estrutural foi apresentada. Na presença de água oxigenada, uma base adicionada ao luminol é capaz de produzir um intermediário que reage imediatamente com a água oxigenada até a formação de uma espécie excitada. Esta última, por sua vez, decai e emite um fóton de luz ( λmáx ~ 430-500 nm). Logo, os “papéis” do sangue, da base e da água oxigenada no mecanismo de quimiluminescência do luminol são, respectivamente:
SiO2(s)+ C(s)⇌ Si (s) + CO2(g)
Se, em uma certa condição experimental, obteve-se 787 kg de silício a partir de 2.000 kg de SiO2 , o rendimento percentual da reação foi de
Dado
MSi: 28 g mol -1
MO: 16 g mol -1
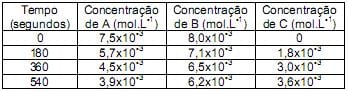
Segundo os dados obtidos acima, é correto afirmar que os módulos das velocidades médias (mol.L-1 .min-1 ) da reação em função da concentração de A, B e C, respectivamente, entre os intervalos de tempo de 3 minutos e 6 minutos, são:
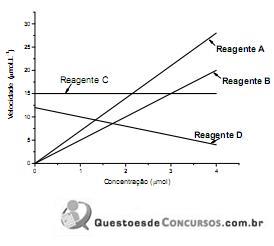
Tendo em vista os resultados do gráfico acima, é incorreto afirmar que o(a)
Quanto à evolução inicial de gás nos copos, como a reação não tem cinética de ordem zero, observa-se
i) A velocidade inicial de uma reação cuja cinética é de primeira ordem depende apenas de um dos reagentes envolvidos no processo reacional.
ii) O tempo de meia-vida de uma reação é aquele intervalo de tempo em que a concentração de um dos reagentes diminui pela metade.
iii) Numa reação com cinética de primeira ordem, todos os tempos de meia-vida do processo têm valores iguais
Com base nessas informações, numa reação de cinética de primeira ordem, um reagente, cuja concentração inicial é 0,60 mol/L, e cujo tempo de meia-vida é igual a 1 min, atinge a concentração de 7,5 x 10-2 mol/L em
Experimentalmente constata-se que a(o)