Questões de Concurso Público IF-PR 2014 para Técnico em Laboratório - Química
Foram encontradas 20 questões
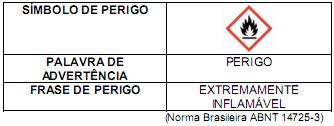
São possíveis precauções a serem tomadas neste caso, exceto:
Na2S2O3(aq)+ I2(aq) → Na2S4O6(aq)+ NaI(aq)
Diante do exposto, assinale a alternativa que apresenta a concentração de iodo presente na solução estoque.
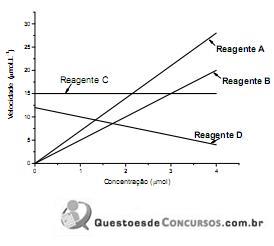
Tendo em vista os resultados do gráfico acima, é incorreto afirmar que o(a)
Equação de Equilíbrio da Solução 1:
2 CrO4-2 (aq) + 4 H+ (aq)
 Cr2O7 -2(aq) + 2 H2O (l)
Cr2O7 -2(aq) + 2 H2O (l) Equação de Equilíbrio da Solução 2:
[CoCl 4] -2 (aq) + 4H2O(l)
 [Co(H2O)4Cl 2](aq) + 2 Cl-(l) ΔH<0
[Co(H2O)4Cl 2](aq) + 2 Cl-(l) ΔH<0 Com base nas informações acima, foram feitos quatro experimentos, com as duas soluções, levando-se em conta as condições para observação do deslocamento do equilíbrio químico. Os resultados foram tabelados abaixo.
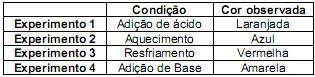
São informações corretas a respeito do estudo efetuado acima, exceto uma. Assinale a alternativa que a apresenta.
Equação 1:
NH4 + (aq) + OH- (aq)
 NH3(aq) +H2O(l)
NH3(aq) +H2O(l) Equação 2:
HSO4 - (aq) + HCO3-(aq)
 SO4 2- (aq) + H2CO3(aq)
SO4 2- (aq) + H2CO3(aq) São pares de base e base conjugada de Bronsted-Lowry, respectivamente, em cada equação:
Na2SO4(aq) + BaCl2 (aq) → NaCl(aq) + BaSO4 (s)
(Dados de massas atômicas (u): Na = 23; S = 32; O = 16; Ba = 137; Cl = 35,5)
Se 50,00mL da solução de sulfato de sódio consome 12,25mL de uma solução a 0,02mol/L de cloreto de bário, assinale a alternativa que apresenta a massa de sulfato de sódio presente.
(Dados: massas molares (g/mol): Mg = 24; Cl = 35,5; H = 1; O = 16)
Pb(NO3)4(s) → Pb(s) + N2O4(g) + O2(g)
(Dado de massas molares (g/mol): Pb(NO3)4 = 455; Pb = 207; N2O4 = 92, O2 = 16)
Então, é correto afirmar que a massa total de nitrato de chumbo (IV) presente na amostra é de, aproximadamente,
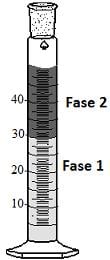
(Densidade(g/ml) a 25°C: óleo mineral = 0,81; água = 1,0)
É correto afirmar que o aumento do volume da fase 1 se deve às interações intermoleculares
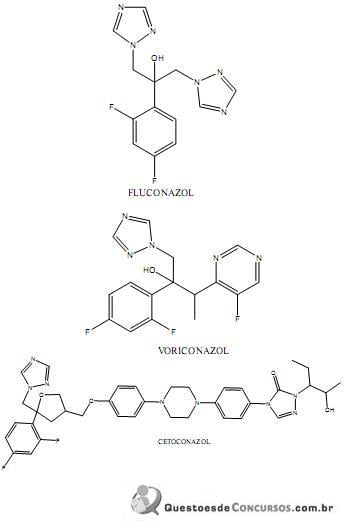
Diante do exposto, assinale a alternativa incorreta.
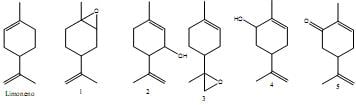
Sobre as estruturas mostradas acima, assinale a alternativa incorreta.
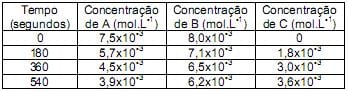
Segundo os dados obtidos acima, é correto afirmar que os módulos das velocidades médias (mol.L-1 .min-1 ) da reação em função da concentração de A, B e C, respectivamente, entre os intervalos de tempo de 3 minutos e 6 minutos, são:
I. A densidade também pode ser considerada como sendo 9,00.102 g/L.
II. Se um rótulo informa que tem 50,0Kg de etilenodiamina, então, o volume da embalagem tem que ser maior do que 100L.
III. É possível considerar que o teor de etilenodiamina é 90,0%(m/v).
IV. A concentração da solução de etilenodiamina pode ser considerada como sendo 15,0mol/L.
É correto o que se afirma em
N2O4(g)
 NO2(g)
NO2(g) Utilizando uma seringa com a ponta fechada, na qual continha uma mistura destas substâncias em estados de equilíbrio químico, no estado físico gasoso, um estudante fez o experimento observando diferenças significativas de coloração. O experimento encontra-se esquematizado abaixo, sendo que (1) representa o estado de equilíbrio químico inicial e (2), o estado de equilíbrio químico final.
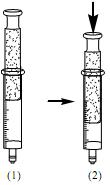
Tendo em vista o estado inicial (1) e o final (2), e que cada um destes estados apresenta uma coloração diferente em estado de equilíbrio, é correto afirmar que o estudante, ao pressionar o pistão da seringa, concluiu que
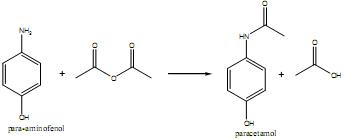
Tendo em vista o processo acima descrito, é correto afirmar que, comparando o paracetamol com o para- aminofenol, o paracetamol