Questões de Concurso Público COSANPA 2017 para Químico
Foram encontradas 13 questões
Em pequenas estações de tratamento de água, dióxido de cloro, um forte agente oxidante, costuma ser preparado in situ de forma a atingir uma concentração de dióxido de cloro de 15 g L-1, conforme equação química dada abaixo:
HCl + NaClO2 → ClO2 + NaCl + H2O
Considerando-se uma estação de tratamento de 10.000 litros, o volume, em litros, de ácido clorídrico necessário para atingir a concentração de dióxido de cloro necessária é de aproximadamenteObs.: Considere que a reação ocorre estequiometricamente com rendimento de 100%. Dados: Massas molares, g mol-1: H = 1; Cl = 35,5; Na = 23; O = 16. Ácido Clorídrico: densidade = 1,2 g mL-1; Título (em massa): 37%.
A dureza total de uma amostra de 50,0 mL de água foi determinada por titulação com EDTA de concentração 0,010 mol L-1. O volume de EDTA gasto foi de 8,00 mL. A dureza total dessa amostra de água, expressa em mg CaCO3 por litro (mg L-1 CaCO3), é de
Dado: massa molar CaCO3 = 100 g mol-1
.
Uma determinada estação de tratamento faz a desinfecção de água residual com HOCl e, após o processo, determinou-se que o teor total de HClO restante (expresso como Cl2) é de 2 mg L-1. Antes da liberação desta água para o ambiente, é necessário eliminar-se o excesso de HClO, o que é feito reduzindo-o a cloreto pela adição de uma solução de bissulfito de sódio (NaHSO3) 0,1 mol L-1. Se o fluxo de água residual a ser tratada é de 2 m3 s-1, a taxa da solução de bissulfito de sódio (em L s-1) que deve ser adicionada ao fluxo de água residual para uma completa inativação do cloro é de aproximadamente
Observação:
Considere que o fluxo da solução de NaHSO3 é desprezível em relação ao fluxo da estação.
Dados:
Massa molar (g mol-1): NaHSO3 = 104; Cl2 = 71; HOCl = 52,5.
Cl2 + 2H2O → 2HOCl + 2H+ + 2e-
2HSO3- + 2HOCl → 2SO42- + 2Cl- + 4H+
A determinação de nitrato é uma importante aplicação da espectroscopia eletrônica no ultravioleta – visível (uv-vis) para o monitoramento da qualidade da água. Os espectros no uv-vis (numerados de 1 a 5) de cinco amostras com concentrações de nitrato (g L-1) de 7,0; 1,4; 0,15; 0,015; e 0,005 foram registrados, utilizando-se uma cela de caminho ótico de 1 cm, e estão mostrados na figura abaixo.
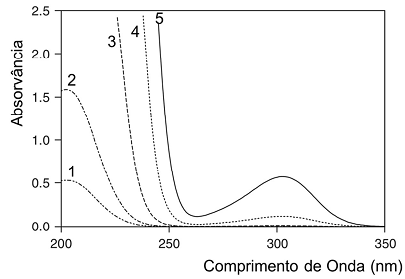
Entre eles, o espectro que tem concentração de nitrato igual a 0,015 g L-1 é o de número
Dados: massa molar CaCO3 = 100,0 g mol-1 .
Dados massas atômica (g mol-1): Fe = 56; O = 16.
O espectro no infravermelho de um composto obtido pela oxidação avançada de matéria orgânica
por radicais hidroxila é dado abaixo.
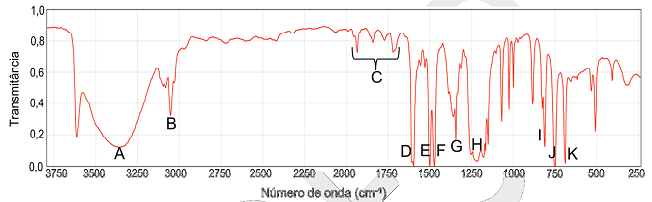
Dados:
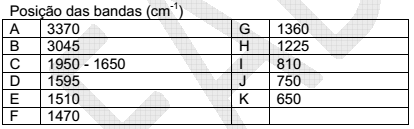
Após tratamento de desinfecção por compostos clorados, a contaminação por trihalometanos de água para consumo humano foi analisada por cromatografia gasosa acoplada a espectrometria de massas. O espectro de massas obtido, parcialmente representado na figura abaixo, mostrou a presença de três diferentes trihalometanos.
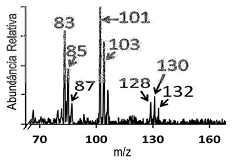
A análise do espectro mostra que o grupo de sinas a m/z iguais a 128, 130 e 132 deve-se ao
Dados: Massas atômicas (g mol-1): H = 1; C = 12; F = 19; Cl = 35,5; Br = 80.
Dados massas molares (g mol-1): NaOH = 40,0; KHP = 204,22.
Uma análise iodométrica por titulação indireta foi utilizada para se determinar o teor de NaOCl de um desinfectante adquirido por uma estação de tratamento de água. Para isso, 25,0 mL do desinfectante foram diluídos a 1000 mL em um balão volumétrico. Um volume de 25,0 mL dessa solução diluída foi transferida para um erlenmeyer e tratada com excesso de KI, reduzindo OCl- a Cl- e produzindo I3- . A redução de I3- a I- foi executada via titulação com uma solução 0,10 mol L-1 de Na2S2O3, (que foi oxidado a Na2S4O6). Foram necessários 9,00 mL para se atingir o ponto de viragem do indicador utilizado. Assim, o percentual em %m/v, de NaOCl no desinfectante adquirido é de aproximadamente
Dados massas molares (g mol-1): O = 16; Na = 23; S = 32; Cl = 35,5; I = 127.