Questões de Concurso
Sobre química orgânica e farmacêutica em farmácia
Foram encontradas 272 questões
A cromatografia líquida de alta eficiência (CLAE) pode ser utilizada para a análise de compostos de várias classes, incluídos medicamentos e drogas de abuso. Considerando os fundamentos teóricos dessa técnica e as substâncias acima representadas, julgue o próximo item.
O espectrômetro de massas (EM) é um detector com grande
aplicação na CLAE atualmente, sendo o analito, no sistema
CLAE/EM, ionizado por impacto de elétrons.
A cromatografia líquida de alta eficiência (CLAE) pode ser utilizada para a análise de compostos de várias classes, incluídos medicamentos e drogas de abuso. Considerando os fundamentos teóricos dessa técnica e as substâncias acima representadas, julgue o próximo item.
A morfina pode ser analisada por CLAE com detector de
fluorescência, no qual a substância é excitada com radiação de
comprimento de onda definido, normalmente, na região de
ultravioleta, emitindo radiação em comprimento de onda mais
longo, normalmente, na região do visível. Como somente
algumas substâncias possuem essa propriedade, considera-se
elevada a seletividade desse detector.
A cromatografia líquida de alta eficiência (CLAE) pode ser utilizada para a análise de compostos de várias classes, incluídos medicamentos e drogas de abuso. Considerando os fundamentos teóricos dessa técnica e as substâncias acima representadas, julgue o próximo item.
Um dos detectores mais utilizados na CLAE é o de
ultravioleta, que pode detectar todos os compostos acima
representados.
A cromatografia líquida de alta eficiência (CLAE) pode ser utilizada para a análise de compostos de várias classes, incluídos medicamentos e drogas de abuso. Considerando os fundamentos teóricos dessa técnica e as substâncias acima representadas, julgue o próximo item.
Considere que a análise de uma amostra de urina de um
motorista suspeito de estar sob efeito de substância psicoativa
seja realizada por CLAE com espectrômetro de massas.
Considere também que a cocaína tenha massa molecular igual
a 303 u. Nessa situação, confirmada a presença de cocaína e de
uma substância com m/z = 290 u, esta deve ser identificada
como o metabólito benzoilecgonina.
As plantas contêm diversos metabólitos secundários e a extração desses metabólitos depende do meio extrator. A escolha do método e dos reagentes deve levar em consideração a maximização da eficiência da reação e a garantia do maior ou do menor número de metabólitos, dependendo do caso em estudo. Acerca desse assunto, julgue o próximo item.
.endo a cocaína um alcaloide em forma de éster, a extração
desse metabólito a partir das folhas de coca pode ser efetuada
por intermédio de uma base fraca e um solvente orgânico.


( ) Polimorfismo é a habilidade de uma substância química de existir em duas ou mais formas moleculares, porém com a mesma conformação cristalina.
( ) Embora com composições químicas idênticas, os polimorfos podem apresentar propriedades físico- químicas distintas, como solubilidade, taxa de dissolução, estabilidade química, cor e ponto de fusão.
( ) A importância do controle do polimorfismo no desenvolvimento de compostos bioativos de uso terapêutico está relacionada principalmente às suas diferenças de solubilidade, que podem afetar a biodisponibilidade e, portanto, sua eficácia.
( ) A determinação de polimorfismo pode ser realizada por cromatografia líquida de alta eficiência (HPLC ou CLAE); por esse motivo, tais equipamentos estão presentes em todas as indústrias farmacêuticas.
( ) A determinação da presença de polimorfos, o conhecimento de como eles podem ser monitorados e como afetarão a formulação são fundamentais no desenvolvimento de medicamentos genéricos.
Observe, abaixo, a reação de síntese de anilina.
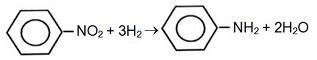
Essa reação refere-se à seguinte rota de síntese de aminas:
I. Os aldeídos aromáticos são menos reativos em reações de adição nucleofílicas que os aldeídos alifáticos.
II. Os aldeídos são geralmente mais reativos que as cetonas em reações de adição nucleofílica.
III. Em reações de substituição nucleofílica do tipo SN2, a reatividade de halogenetos de alquila primários é menor do que a dos secundários.
IV. Quanto maior a basicidade do nucleófilo, menor será a sua reatividade em uma reação de substituição nucleofílica.
É correto o que se afirma em
COLUNA I
1. Terpeno
2. Flavonoide
3. Tanino
4. Cumarina
COLUNA II
( )
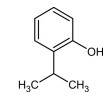
( )
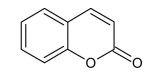
( )
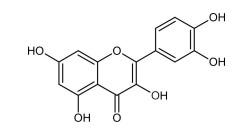
( )
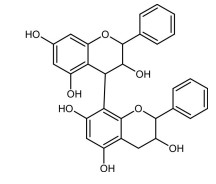
Assinale a alternativa que apresenta a sequência de números CORRETA.
Marque a alternativa abaixo que tem o carbocátion mais estável.
Diante dessas informações e de seus conhecimentos, marque a substância mais ácida.


