Questões de Concurso Comentadas sobre química
Foram encontradas 7.319 questões
Texto para a questão.
Surfactantes ou agentes tensoativos são moléculas que se associam espontaneamente, em solução aquosa, a partir de uma determinada concentração. Apresentam uma região apolar e outra polar, ou iônica, e podem ser divididos em neutros ou iônicos. Os tensoativos iônicos podem ser catiônicos ou aniônicos ou, ainda, anfóteros, quando ambas as cargas estão presentes no surfactante. Em soluções diluídas, as moléculas dos surfactantes apresentam-se dispersas e, em soluções mais concentradas, organizam-se em agregados moleculares, que geralmente contêm de 50 a 100 moléculas, denominadas de micelas.
I. M. Rizzatti, D. R. Zanette e L. C. Mello. Determinação
potenciométrica da concentração micelar crítica de
surfactantes: uma nova aplicação metodológica
no ensino de química. In: Química Nova, v. 32,
n.° 2, 2009, p. 518-521 (com adaptações).
J. M. Riveros (editorial). O legado de Niels Bohr. In: Química Nova, v. 36, n.° 7, 2013, p. 931-932 (com adaptações).
Quanto ao postulado para o átomo de hidrogênio apresentado pelo modelo teórico para a estrutura eletrônica de átomos proposto por Bohr, que se baseia no modelo planetário introduzido por Rutherford, assinale a alternativa correta.
Considerando-se a seguinte reação, que envolve íons do
átomo de cobre 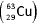 : Cu2+ (aq) + e- → Cu+ (aq), assinale a
alternativa que apresenta, correta e respectivamente, o
número de prótons, elétrons e nêutrons da espécie iônica de
cobre produto dessa reação.
: Cu2+ (aq) + e- → Cu+ (aq), assinale a
alternativa que apresenta, correta e respectivamente, o
número de prótons, elétrons e nêutrons da espécie iônica de
cobre produto dessa reação.
Texto para a questão.
Curvas de solubilidade em água em função da temperatura para algumas substâncias

Texto para a questão.
Curvas de solubilidade em água em função da temperatura para algumas substâncias

Deseja-se preparar duas soluções saturadas na temperatura de 20 °C, uma contendo o sal menos solúvel e outra contendo o sal mais solúvel nessa temperatura. Para cada uma das soluções, será empregado o mínimo possível dos sais e será utilizado 1 L de água, mantida a 20 °C durante todo o processo de dissolução. A massa específica da água é igual a 1.000 kg m-3.
Com base nesse caso hipotético e no gráfico, assinale a alternativa que apresenta, correta e respectivamente, as massas aproximadas dos dois sais necessárias para o preparo dessas soluções.
Texto para a questão.
Curvas de solubilidade em água em função da temperatura para algumas substâncias

Texto para a questão.
A solubilidade é um dos temas mais relevantes da área da química, tanto por sua importância intrínseca quanto pela variedade de fenômenos e propriedades químicas envolvidas em seu entendimento. O processo de solubilização de uma substância resulta da interação entre a espécie que se deseja solubilizar (soluto) e a substância que a dissolve (solvente) e pode ser definida como a quantidade de soluto que dissolve, em uma determinada quantidade de solvente, em condições de equilíbrio. Solubilidade é, portanto, um termo quantitativo.
C. R. Martins, W. A. Lopes e J. B. Andrade. Solubilidade das
substâncias orgânicas. In: Química Nova, v. 36, n.° 8,
2013, p. 1.248-1.255 (com adaptações).
Texto para a questão.
A solubilidade é um dos temas mais relevantes da área da química, tanto por sua importância intrínseca quanto pela variedade de fenômenos e propriedades químicas envolvidas em seu entendimento. O processo de solubilização de uma substância resulta da interação entre a espécie que se deseja solubilizar (soluto) e a substância que a dissolve (solvente) e pode ser definida como a quantidade de soluto que dissolve, em uma determinada quantidade de solvente, em condições de equilíbrio. Solubilidade é, portanto, um termo quantitativo.
C. R. Martins, W. A. Lopes e J. B. Andrade. Solubilidade das
substâncias orgânicas. In: Química Nova, v. 36, n.° 8,
2013, p. 1.248-1.255 (com adaptações).
Texto para a questão.
A solubilidade é um dos temas mais relevantes da área da química, tanto por sua importância intrínseca quanto pela variedade de fenômenos e propriedades químicas envolvidas em seu entendimento. O processo de solubilização de uma substância resulta da interação entre a espécie que se deseja solubilizar (soluto) e a substância que a dissolve (solvente) e pode ser definida como a quantidade de soluto que dissolve, em uma determinada quantidade de solvente, em condições de equilíbrio. Solubilidade é, portanto, um termo quantitativo.
C. R. Martins, W. A. Lopes e J. B. Andrade. Solubilidade das
substâncias orgânicas. In: Química Nova, v. 36, n.° 8,
2013, p. 1.248-1.255 (com adaptações).
SKOOG, D. A.; KOLLER, F. J.; NIEMAN, T. A. Princípios da Análise Instrumental. 5ª ed. Porto Alegre: Bookman, 2002.
Com relação aos princípios da técnica de cromatografia iônica, assinale V para a afirmativa verdadeira e F para a falsa.
( ) Íons monovalentes ficam retidos na coluna de troca iônica mais fortemente que íons polivalentes. ( ) Resinas trocadoras de cátions comuns exibem sítios ativos que contém grupos ácidos sulfônicos ou carboxílicos. ( ) A ordem de eluição em colunas trocadoras de ânions esperada para os haletos é F- , Cl- , Br- , I- .
Segundo a ordem apresentada, as afirmativas são, respectivamente,
1) H2S (aq) + 4 Cl2 (aq) + 4 H2O (liq)
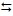 8 HCl (aq) + H2SO4 (aq)
2) 2 Fe(HCO3)2 (aq) + Cl2 (aq) + Ca(HCO3)2 (aq)
8 HCl (aq) + H2SO4 (aq)
2) 2 Fe(HCO3)2 (aq) + Cl2 (aq) + Ca(HCO3)2 (aq) 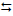 2 Fe(OH)3 (s) + CaCl2
(aq) + 6 CO2 (g)
3) MnSO4 (aq) + Cl2 (aq) + 4 NaOH (aq)
2 Fe(OH)3 (s) + CaCl2
(aq) + 6 CO2 (g)
3) MnSO4 (aq) + Cl2 (aq) + 4 NaOH (aq) 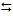 MnO2 (ppt) + 2 NaCl (aq) +
Na2SO4 (aq) + 2H2O (liq)
MnO2 (ppt) + 2 NaCl (aq) +
Na2SO4 (aq) + 2H2O (liq)
Analise as afirmativas a seguir, relacionadas com as reações.
I. Na reação 1, o enxofre sofre oxidação e o cloro é o agente redutor. II. Na reação 2, o ferro sofre oxidação e o cloro sofre redução. III. Na reação 3, o manganês sofre redução e o cloro é o agente oxidante.
Está correto o que se afirma em
A alcalinidade total da amostra, em mgCaCO3.L-1, corresponde aproximadamente a
Dados: massas molares em g.mol-1: C = 12; O = 16; Ca = 40. Equação para a titulação: 2HCl + CaCO3 → CaCl2 + H2O + CO2.
Se a quantidade de matéria orgânica e de microrganismos aeróbios no esgoto for alta, a diminuição da concentração de oxigênio dissolvido no meio provocará alterações no ambiente aquático.
A quantidade de oxigênio necessária para o consumo da matéria orgânica pode ser avaliada em laboratório, utilizando o excesso do reagente
O volume previsto de titulado que deverá ser gasto nesse processo, considerando nenhum tipo de perda será de
Dados: massas molares (g.mol-1) C= 12; O=16; Na= 23.
A adição de NH3(aq) a uma solução saturada de cloreto de prata em contato com o precipitado resultará