Questões de Concurso Público SEDUC-CE 2009 para Professor - Química
Foram encontradas 37 questões
Considerando as informações acima, assinale a opção correta.
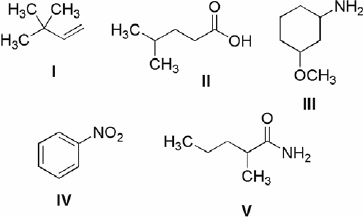
Considerando as reações orgânicas mais comuns, os princípios de acidez e basicidade de compostos orgânicos e mecanismos de reação, assinale a opção correta:
I. Nas reações de adição eletrofílica em alcenos, há a formação de um intermediário radical.
II. A estabilidade de intermediários carbocátions está relacionada aos efeitos de hiperconjugação e indutivo. Carbocátions terciários são mais estáveis que os secundários que são mais estáveis que os primários.
III. Nas reações de substituição nucleofílica bimolecular ou de segunda ordem (SN2) ocorre a formação de um intermediário carbocátion.
IV. Os compostos aromáticos fazem reações de substituição eletrofílica, contrariamente aos alcenos, que fazem reações de adição eletrofílica.
Estão certos apenas os itens:

Com base nesse processo e nos conceitos de equilíbrio químico, assinale a opção correta.
I. O princípio de Le Châtelier prevê que se um sistema emequilíbrio fica sujeito a uma variação na temperatura,pressão ou concentração de um dos reagentes, o sistemamantém sua posição de equilíbrio de tal forma que o valor daconstante de equilíbrio se mantenha constante. II. A presença de um catalisador no meio reacional aumenta avelocidade na qual o equilíbrio é atingindo, sem alterar acomposição da mistura no equilíbrio. III. As variações nas concentrações ou pressões parciais provocam deslocamentos no equilíbrio sem variação no valor da constante de equilíbrio. Entretanto, o valor daconstante de equilíbrio varia à medida que a temperaturavaria. IV. A uma temperatura constante, a redução do volume de umdos reagentes em uma mistura gasosa em equilíbrio faz queo sistema se desloque no sentido dos reagentes.Quando a concentração de reagentes e produtos em um meio reacional não varia com o passar do tempo, pode-se dizer que a reação chegou a um estado de equilíbrio, em que as reações direta e inversa acontecem com a mesma velocidade. Entretanto, vários fatores podem alterar a posição de equilíbrio de uma reação. Com base nessas informações, julgue os itens a seguir
Estão certos apenas os itens:
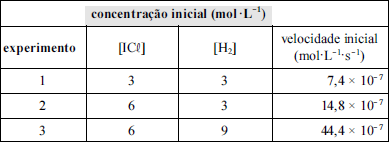
A tabela acima apresenta dados cinéticos obtidos em um experimento acerca da reação química a seguir.

Nessa situação, a ordem de velocidade em relação a cada reagente (ICl) e (H2), a ordem global da velocidade da reação e a lei de velocidade para a reação escolhida é:

Com base na equação acima, nos conceitos da estequiometria e sabendo que M(C) = 12 g/mol, M(H) = 1 g/mol, M(O) = 16 g/mol, assinale a opção correta:
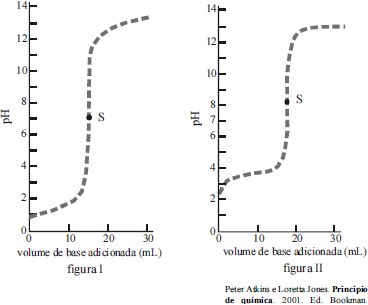
Uma das técnicas usadas na determinação da concentração de um soluto é a titulação. Essa técnica é utilizada com frequência em laboratórios de pesquisa, indústria e laboratórios de análises clínicas e forense. Com base na técnica de titulação e nas figuras I e II acima, assinale a opção correta: