Questões de Concurso Público COMPESA 2016 para Analista de Saneamento - Químico
Foram encontradas 24 questões
Para uma determinada pratica em laboratório é necessário o preparo de 200 mL de solução 0,5 mol.L–1 de ácido nítrico a partir de uma solução concentrada desse ácido. A solução concentrada é identificada por: 65%(m/m) e densidade 1,4g.cm–3 .
O volume a ser utilizado dessa solução é de, aproximadamente,
Dados: Massas molares: H = 1g.mol-1 ; N = 14g.mol-1 ; O = 16g.mol-1
A reação de cloro gasoso com uma base forte pode ser descrita pela equação
Cℓ2(g) + 2 NaOH(aq) → NaCℓ(aq) + NaOCℓ(aq) + H2O(ℓ)
Para o posterior preparo de 0,5 litro de solução 0,2 mol.L–1 de hipoclorito de sódio obtido por meio desse processo, a massa de hidróxido de sódio que deve reagir em presença de excesso de cloro gasoso é, no mínimo, igual a
Dados: Massas molares H = 1g.mol–1 ; O = 16g.mol–1 Na = 23g.mol–1
Uma mistura gasosa de 10 mmol de CO e 10 mmol de H2O é colocada em um reator de 500 mL e aquecida até 500 °C, atingindo o equilíbrio:
CO(g) + H2O(g) ⇄ CO2(g) + H2(g) com Kc = 4,00
A concentração, em mol.L–1 de dióxido de carbono nesse
equilíbrio é de
A amônia atmosférica é de fundamental importância para a química ambiental, pois se trata de um composto capaz de neutralizar, em determinada extensão, gases ácidos e espécies ácidas adsorvidas em partículas.
Em uma determinada temperatura, a amônia apresenta pKb= 5. Nessas condições uma solução 0,1mol.L–1 de amônia apresentará valor de pH igual a
Dado: pKw = 14
Em 1923, o químico dinamarquês Johannes Brønsted (1879- 1947) e o químico inglês Thomas Lowry (1874-1936) propuseram uma definição de ácidos e bases mais geral do que a proposta anteriormente por Arrhenius (1859-1927).
O conceito de Brønsted- Lowry está baseado no fato de que a reação ácido-base envolve transferência de íons H+ de uma substância para outra.
Analise o equilíbrio a seguir:
HSO3 – (aq)+ H2O(ℓ) ⇄ H2SO3(aq) +OH– (aq)
Baseado nesse conceito, os pares conjugados são:
A piretrina e a aletrina, cujas estruturas estão representadas a seguir, são inseticidas naturais muito utilizados no controle de pragas agrícolas, antes da Segunda Guerra Mundial.
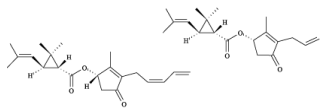
Hoje, esses e outros compostos naturais inspiram a busca por biopesticidas, substâncias produzidas pela natureza que são capazes de atuar no controle de pragas. O objetivo é que os biopesticidas, que causam menos danos ao ecossistema, substituam paulatinamente os inseticidas sintéticos.
As cadeias carbônicas da piretrina e da aletrina possuem
Para determinar a concentração de ortofosfato em uma amostra foi utilizado o método do ácido ascórbico. Nesse método, o ácido ascórbico reage com o ortofosfato, na presença de molibdato de amônio e de antimonil tartarato de potássio em meio ácido, formando o ácido fosfomolíbdico, que será reduzido formando azul de molibdênio. A intensidade da coloração da substância observada em espectofotômetro em comprimento de onda 880 nm indica a concentração de ortofostato.
A curva de calibração a seguir foi obtida utilizando o método do ácido ascórbico para amostras padrões de ortofosfato.
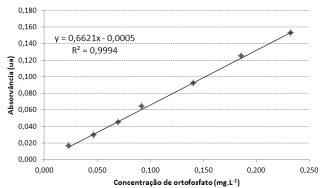
Uma amostra desconhecida contendo ortofosfato apresentou
absorvância 0,090 ua seguindo as mesmas condições de análise.
A concentração de ortofosfato, em mg.L-1
, nessa amostra é de,
aproximadamente,
Na preparação de uma curva de calibração para analisar nitrato em amostras de água por meio da técnica de cromatografia iônica, um analista utilizou uma solução padrão de concentração inicial 99,6 mg.L–1 e preparou diferentes volumes de soluções com diferentes concentrações.
A tabela a seguir apresenta volumes utilizados da solução padrão e concentrações das soluções preparadas.
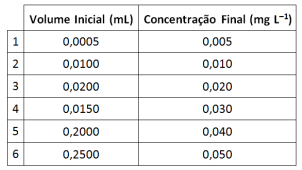
Os maiores volumes (em mL) preparados foram os
correspondentes às soluções
Os sais de nitrato são compostos iônicos muito solúveis em água. Quando se coloca 1 mol de nitrato de cálcio em 1 litro de água ocorre a formação de uma solução na qual os íons estão separados e solvatados por moléculas de água.
Nessa solução, as concentrações em mol.L-1 dos íons cálcio e nitrato, presentes na solução são, respectivamente,
O tratamento convencional da água inclui os processos de coagulação, floculação, filtração, desinfecção, ajuste do pH e fluoretação. Nas etapas do tratamento da água podem ser utilizados os produtos químicos permanganato de potássio, cloreto de ferro (III), sulfato de ferro (III), carbonato de sódio e hipoclorito de sódio.
Estes produtos são adequadamente utilizados nos processos
Uma das etapas do tratamento de água envolve a retirada de impurezas coloidais que não sedimentam com facilidade. Essa etapa do processo ocorre em misturadores adequados, nos quais são adicionadas à água substâncias químicas que promovem a formação de flocos coloidais. Em seguida, a água é conduzida para tanques e o processo de tratamento prossegue.
A operação de separação que ocorre nesses tanques é denominada
As substâncias húmicas presentes em resíduos e no solo podem ser classificadas de acordo com sua solubilidade como humina, ácido húmico e ácido fúlvico. De acordo com suas propriedades as substâncias húmicas podem influenciar as características de corpos d’água significativamente.
Entre as propriedades das substâncias húmicas está a capacidade de
Para padronizar uma solução de ácido clorídrico, um analista pesou 0,764 g de bórax e transferiu quantitativamente para um erlenmeyer, dissolvendo em 50 mL de água destilada. Esta solução foi titulada até coloração rosa com o ácido clorídrico em presença de três gotas do indicador vermelho de metila consumindo 40,00 mL do ácido clorídrico.
A concentração do ácido titulado (em mol.L-1 ) é igual a
Dados: Massa molar do bórax (Na2B4O7.10H2O) = 382g.mol-1
Os resíduos gerados nos laboratórios comumente precisam ser tratados antes do descarte na rede de esgoto. Os tratamentos devem considerar suas características e periculosidade.
O tratamento de sais de metais pesados deve incluir
A Norma ABNT NBR ISSO/IEC 17025:2005 especifica os requisitos gerais que os laboratórios precisam cumprir para ter a competência de realizar ensaios e/ou calibrações, incluindo amostragem.
Sobre o processo de validação de um método, analise as ações a seguir.
I. Calibração com utilização de padrões de referência.
II. Comparações interlaboratoriais.
III Comparações com resultados obtidos por outros métodos.
Segundo a Norma ABNT NBR ISSO/IEC 17025:2005 pode(m) ser adotada(s):
Nossas reservas d’água são afetadas por várias formas de poluição: biológica, térmica, sedimentar e química. Embora os sedimentos constituam a maior quantidade de poluentes, os agentes químicos são os potencialmente mais nocivos.
Os tratamentos dos efluentes devem considerar os agentes poluidores, as características do corpo d’água e sua utilização.
Sobre os tratamentos empregados, assinale a afirmativa correta.
As partículas que devem ser removidas da água por tratamento iniciado pela coagulação são, em geral, negativamente carregadas e os coagulantes usados no tratamento de águas, normalmente, apresentam espécies positivamente carregadas. A eficiência do processo de coagulação depende, entre outros fatores, da natureza do cátion.
Dessa forma, sulfatos de alumínio, cálcio ou sódio devem agir como coagulantes, porém com eficiência de coagulação diferenciadas.
Assinale a opção que expressa corretamente a tendência na eficiência de coagulação promovida pelos diferentes sais.
A operação de separação de uma mistura, pela ação da gravidade, gerando um fluido claro e um lodo de alto teor de sólidos, é chamada de sedimentação.
Após as operações unitárias de separação baseadas no processo de sedimentação, o corpo hídrico deverá apresentar
As estações de tratamento de águas convencionais são compostas por operações unitárias que incluem coagulação, floculação, decantação e filtração.
Acerca da etapa de filtração, analise as afirmativas a seguir.
I. A filtração consiste na remoção de partículas suspensas e partículas coloidais.
II. A filtração é realizada fazendo-se o corpo hídrico passar através de um meio filtrante, geralmente constituído por areia.
III. A eficiência da filtração depende do tamanho das partículas em suspensão.
Está correto o que se afirma em
O Art. 34 da portaria GM 2914/2011 do Ministério da Saúde, diz: “É obrigatória a manutenção de, no mínimo, 0,2 mg/L de cloro residual livre ou 2 mg/L de cloro residual combinado ou de 0,2 mg/L de dióxido de cloro em toda a extensão do sistema de distribuição (reservatório e rede).”
Entende-se por cloro residual combinado,