Questões de Concurso Público COMPESA 2016 para Analista de Saneamento - Químico
Foram encontradas 60 questões
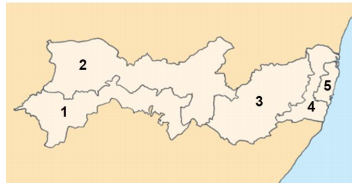 “Mesorregião” é uma área geográfica que apresenta
similaridades naturais, econômicas e sociais que contribuíram
para criar uma identidade regional ao longo do tempo.
Com base no mapa acima, identifique as cinco mesorregiões do
Estado de Pernambuco.
( ) Metropolitana do Recife
( ) São Francisco
( ) Sertão
( ) Zona da Mata
( ) Agreste
Assinale a opção que indica a sequência correta, de cima para
baixo.
“Mesorregião” é uma área geográfica que apresenta
similaridades naturais, econômicas e sociais que contribuíram
para criar uma identidade regional ao longo do tempo.
Com base no mapa acima, identifique as cinco mesorregiões do
Estado de Pernambuco.
( ) Metropolitana do Recife
( ) São Francisco
( ) Sertão
( ) Zona da Mata
( ) Agreste
Assinale a opção que indica a sequência correta, de cima para
baixo. Com base no trecho citado, analise as afirmativas a seguir sobre o impacto das ações de responsabilidade socioambiental. I. As espécies introduzidas para repovoar o rio têm importância ecológica e econômica, pois fazem parte da cadeia alimentar natural, além de servir como fonte de renda para os pescadores da região. II. O peixamento é uma oportunidade de educar as crianças e de conscientizar os pais sobre a importância de preservar o rio São Francisco. III. O objetivo da ação é chamar a atenção da sociedade para os problemas de poluição, degradação e assoreamento do maior rio que nasce e deságua em território nacional. Está correto o que se afirma em:
Para uma determinada pratica em laboratório é necessário o preparo de 200 mL de solução 0,5 mol.L–1 de ácido nítrico a partir de uma solução concentrada desse ácido. A solução concentrada é identificada por: 65%(m/m) e densidade 1,4g.cm–3 .
O volume a ser utilizado dessa solução é de, aproximadamente,
Dados: Massas molares: H = 1g.mol-1 ; N = 14g.mol-1 ; O = 16g.mol-1
A reação de cloro gasoso com uma base forte pode ser descrita pela equação
Cℓ2(g) + 2 NaOH(aq) → NaCℓ(aq) + NaOCℓ(aq) + H2O(ℓ)
Para o posterior preparo de 0,5 litro de solução 0,2 mol.L–1 de hipoclorito de sódio obtido por meio desse processo, a massa de hidróxido de sódio que deve reagir em presença de excesso de cloro gasoso é, no mínimo, igual a
Dados: Massas molares H = 1g.mol–1 ; O = 16g.mol–1 Na = 23g.mol–1
Uma mistura gasosa de 10 mmol de CO e 10 mmol de H2O é colocada em um reator de 500 mL e aquecida até 500 °C, atingindo o equilíbrio:
CO(g) + H2O(g) ⇄ CO2(g) + H2(g) com Kc = 4,00
A concentração, em mol.L–1 de dióxido de carbono nesse
equilíbrio é de
A amônia atmosférica é de fundamental importância para a química ambiental, pois se trata de um composto capaz de neutralizar, em determinada extensão, gases ácidos e espécies ácidas adsorvidas em partículas.
Em uma determinada temperatura, a amônia apresenta pKb= 5. Nessas condições uma solução 0,1mol.L–1 de amônia apresentará valor de pH igual a
Dado: pKw = 14
Em 1923, o químico dinamarquês Johannes Brønsted (1879- 1947) e o químico inglês Thomas Lowry (1874-1936) propuseram uma definição de ácidos e bases mais geral do que a proposta anteriormente por Arrhenius (1859-1927).
O conceito de Brønsted- Lowry está baseado no fato de que a reação ácido-base envolve transferência de íons H+ de uma substância para outra.
Analise o equilíbrio a seguir:
HSO3 – (aq)+ H2O(ℓ) ⇄ H2SO3(aq) +OH– (aq)
Baseado nesse conceito, os pares conjugados são:
A piretrina e a aletrina, cujas estruturas estão representadas a seguir, são inseticidas naturais muito utilizados no controle de pragas agrícolas, antes da Segunda Guerra Mundial.
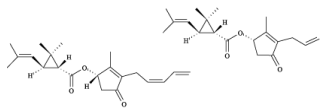
Hoje, esses e outros compostos naturais inspiram a busca por biopesticidas, substâncias produzidas pela natureza que são capazes de atuar no controle de pragas. O objetivo é que os biopesticidas, que causam menos danos ao ecossistema, substituam paulatinamente os inseticidas sintéticos.
As cadeias carbônicas da piretrina e da aletrina possuem
Para determinar a concentração de ortofosfato em uma amostra foi utilizado o método do ácido ascórbico. Nesse método, o ácido ascórbico reage com o ortofosfato, na presença de molibdato de amônio e de antimonil tartarato de potássio em meio ácido, formando o ácido fosfomolíbdico, que será reduzido formando azul de molibdênio. A intensidade da coloração da substância observada em espectofotômetro em comprimento de onda 880 nm indica a concentração de ortofostato.
A curva de calibração a seguir foi obtida utilizando o método do ácido ascórbico para amostras padrões de ortofosfato.
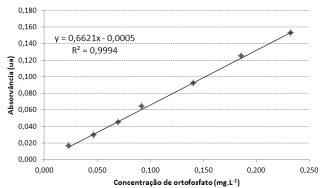
Uma amostra desconhecida contendo ortofosfato apresentou
absorvância 0,090 ua seguindo as mesmas condições de análise.
A concentração de ortofosfato, em mg.L-1
, nessa amostra é de,
aproximadamente,
Na preparação de uma curva de calibração para analisar nitrato em amostras de água por meio da técnica de cromatografia iônica, um analista utilizou uma solução padrão de concentração inicial 99,6 mg.L–1 e preparou diferentes volumes de soluções com diferentes concentrações.
A tabela a seguir apresenta volumes utilizados da solução padrão e concentrações das soluções preparadas.
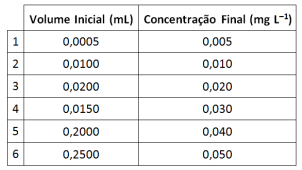
Os maiores volumes (em mL) preparados foram os
correspondentes às soluções
Os sais de nitrato são compostos iônicos muito solúveis em água. Quando se coloca 1 mol de nitrato de cálcio em 1 litro de água ocorre a formação de uma solução na qual os íons estão separados e solvatados por moléculas de água.
Nessa solução, as concentrações em mol.L-1 dos íons cálcio e nitrato, presentes na solução são, respectivamente,
O tratamento convencional da água inclui os processos de coagulação, floculação, filtração, desinfecção, ajuste do pH e fluoretação. Nas etapas do tratamento da água podem ser utilizados os produtos químicos permanganato de potássio, cloreto de ferro (III), sulfato de ferro (III), carbonato de sódio e hipoclorito de sódio.
Estes produtos são adequadamente utilizados nos processos