Questões de Concurso Público SEDF 2017 para Professor de Educação Básica - Química
Foram encontradas 118 questões
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
De acordo com o modelo atômico de Rutherford-Bohr, quando
aquecidos, diferentes elementos químicos geram diferentes
cores porque emitem radiação contínua.
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
O isótopo neutro Ba-88 possui 38 prótons e 50 nêutrons em
seu núcleo, além de 38 elétrons na região extranuclear.
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
No estado fundamental de energia, o íon Cu2+ apresenta
6 elétrons em orbitais s, 12 elétrons em orbitais p e 9 elétrons
em orbitais d.
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
A partir da fórmula unitária do sal cromato de estrôncio,
infere-se que a fórmula molecular do ácido crômico é HCrO4.
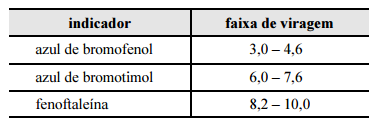
Considerando a situação descrita e a tabela apresentada, que contém faixas de viragem de diferentes indicadores, julgue o item subsequente. Se o volume gasto da solução padrão de NaOH tiver sido igual a 9,0 mL, então o teor de grupos funcionais básicos presentes na amostra é superior a 0,60 mmol/g.
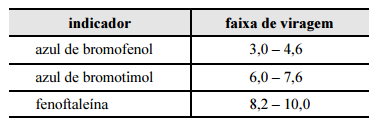
Considerando a situação descrita e a tabela apresentada, que contém faixas de viragem de diferentes indicadores, julgue o item subsequente. Em unidades de massa por volume, a concentração da solução de HCl 0,100 mol/L é superior à da solução padrão de NaOH 0,100 mol/L.
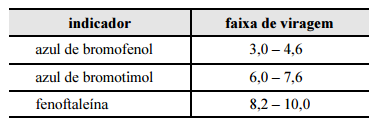
Considerando a situação descrita e a tabela apresentada, que contém faixas de viragem de diferentes indicadores, julgue o item subsequente.
Para preparar 500 mL de uma solução de HCl com concentração 0,100 mol/L, o volume V de solução estoque necessário, em mL, pode ser calculado por meio da equação a seguir, em que MHCl , C% e d representam, respectivamente, a massa molar do HCl (em g/mol), a concentração (em porcentagem massa/massa) e a densidade (em g/mL) da solução estoque.
V= [5 . MHCl / (C% . d)] . mol . %
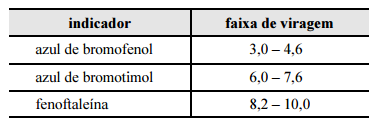
Considerando a situação descrita e a tabela apresentada, que contém faixas de viragem de diferentes indicadores, julgue o item subsequente. Das informações da tabela infere-se que a fenoftaleína é o indicador que ocasiona o menor erro de titulação na titulação entre as soluções de NaOH e HCl.
A química é uma ciência que explica o mundo macroscópico por meio de modelos microscópicos com uma linguagem própria que representa as substâncias e suas transformações. A esse respeito, julgue o item a seguir.
Os catalisadores diminuem a quantidade de energia liberada ou
consumida nas reações químicas.
A química é uma ciência que explica o mundo macroscópico por meio de modelos microscópicos com uma linguagem própria que representa as substâncias e suas transformações. A esse respeito, julgue o item a seguir.
A entalpia não informa se uma reação é espontânea ou não.
A química é uma ciência que explica o mundo macroscópico por meio de modelos microscópicos com uma linguagem própria que representa as substâncias e suas transformações. A esse respeito, julgue o item a seguir.
O sistema internacional de medidas utiliza apenas sete
unidades básicas, entre as quais a quantidade de matéria, cuja
unidade é o mol.
A química é uma ciência que explica o mundo macroscópico por meio de modelos microscópicos com uma linguagem própria que representa as substâncias e suas transformações. A esse respeito, julgue o item a seguir.
A termoquímica permite calcular a energia liberada na forma
de calor por uma reação, considerando-se valores de energia
para ligações químicas.
A química é uma ciência que explica o mundo macroscópico por meio de modelos microscópicos com uma linguagem própria que representa as substâncias e suas transformações. A esse respeito, julgue o item a seguir.
Conforme a teoria cinética dos gases, a energia cinética
independe da temperatura.
Muitas reações químicas não cessam, mas apenas entram em equilíbrio, ou seja, continuam acontecendo microscopicamente, embora não se perceba macroscopicamente. Outras reações acontecem constantemente, mas de forma muito lenta. A respeito desses fatos, julgue o item que se segue.
A relação entre as concentrações das espécies participantes de
um equilíbrio químico pode ser expressa matematicamente por
meio de uma equação que considera a concentração de cada
espécie, independentemente de seu estado físico.
Muitas reações químicas não cessam, mas apenas entram em equilíbrio, ou seja, continuam acontecendo microscopicamente, embora não se perceba macroscopicamente. Outras reações acontecem constantemente, mas de forma muito lenta. A respeito desses fatos, julgue o item que se segue.
Para uma solução aquosa, a soma do pH com o pOH é sempre
igual a 14.
Muitas reações químicas não cessam, mas apenas entram em equilíbrio, ou seja, continuam acontecendo microscopicamente, embora não se perceba macroscopicamente. Outras reações acontecem constantemente, mas de forma muito lenta. A respeito desses fatos, julgue o item que se segue.
O estado de equilíbrio da reação de uma pilha recarregável
é deslocado pela passagem de corrente elétrica.
Muitas reações químicas não cessam, mas apenas entram em equilíbrio, ou seja, continuam acontecendo microscopicamente, embora não se perceba macroscopicamente. Outras reações acontecem constantemente, mas de forma muito lenta. A respeito desses fatos, julgue o item que se segue.
A radioatividade é um fenômeno artificial inventado pelos
cientistas.
Muitas reações químicas não cessam, mas apenas entram em equilíbrio, ou seja, continuam acontecendo microscopicamente, embora não se perceba macroscopicamente. Outras reações acontecem constantemente, mas de forma muito lenta. A respeito desses fatos, julgue o item que se segue.
As transformações radioativas não são consideradas reações
químicas.
A química orgânica demorou a ser estabelecida como uma área da química, pela dificuldade de compreensão da complexidade da combinação de átomos de carbono com átomos de outros elementos químicos como o hidrogênio. A partir dessa compreensão é que se pode, hoje, compreender a estrutura e a funcionalidade de tantas substâncias orgânicas, como, por exemplo, as chamadas biomoléculas.
Tendo como referência inicial as informações apresentadas, julgue o seguinte item.
Detergentes biodegradáveis são aqueles formados por
moléculas com longas cadeias orgânicas sem ramificações
e com número par de átomos de carbono.
A química orgânica demorou a ser estabelecida como uma área da química, pela dificuldade de compreensão da complexidade da combinação de átomos de carbono com átomos de outros elementos químicos como o hidrogênio. A partir dessa compreensão é que se pode, hoje, compreender a estrutura e a funcionalidade de tantas substâncias orgânicas, como, por exemplo, as chamadas biomoléculas.
Tendo como referência inicial as informações apresentadas, julgue o seguinte item.
Alguns aminoácidos são chamados essenciais porque são
produzidos pelo corpo humano.