Questões de Concurso
Sobre controle físico-químico em farmácia
Foram encontradas 319 questões
Para a realização da garantia de qualidade, não é necessário haver uma infraestrutura apropriada com espaço, equipamentos e instalações suficientes englobando procedimentos e recursos organizacionais.
O cumprimento das BPFs está relacionado com a diminuição dos riscos inerentes a qualquer etapa da produção de um medicamento, os quais não podem ser identificados após o produto acabado.
As boas práticas de fabricação (BPFs) constituem um conjunto de normas obrigatórias para a produção de medicamentos e afins, sendo aplicadas apenas em algumas operações envolvidas no processo de fabricação de medicamentos.
Entre as formas de se fazer o controle de qualidade de comprimidos e soluções orais manipuladas, incluem-se os procedimentos que avaliam características sensoriais, pH e densidade relativa.
Sobre esse tema, analise as afirmativas abaixo:
I.Os métodos físicos, químicos, físico-químicos e microbiológicos estão descritos nos compêndios oficiais, que, no caso do Brasil, é a Farmacopeia Brasileira.
II.Na ausência de monografia oficial da forma farmacêutica e de métodos gerais na Farmacopeia Brasileira, poderá ser adotada a monografia oficial de códigos farmacêuticos estrangeiros.
III.Para as formas farmacêuticas líquidas, vários métodos devem ser aplicados para a avaliação da qualidade do produto como: descrição; peso médio; dureza; friabilidade e desintegração.
IV.O teste de dureza é uma técnica de laboratório usada pela indústria farmacêutica para determinar o ponto de ruptura e a integridade estrutural do medicamento descobrindo como ele muda sob condições de armazenamento, transporte, embalagem e manuseio antes do uso.
Qual(is) afirmativa(s) está(ão) CORRETA(S)?
Acerca dessa situação hipotética, julgue o item que se segue.
Uma amostra submetida à diluição prévia de 400 vezes com valor de absorvância de 7,7 possui 100% do teor esperado do ativo.
Acerca dessa situação hipotética, julgue o item que se segue.
Uma amostra para doseamento pode ser preparada, fazendose duas diluições sequenciais de 1:10 em solvente apropriado.
Acerca dessa situação hipotética, julgue o item que se segue.
O limite de quantificação da metodologia citada é de 5,0 μg/mL.
Acerca dessa situação hipotética, julgue o item que se segue.
A maior absorvância que pode ser obtida dentro dos limites da linearidade da metodologia é 15,2.

Está correto o que se afirma apenas em
As operações de produção devem respeitar procedimentos claramente definidos satisfazendo os princípios das Boas Práticas de Fabricação (BPF), a fim de que sejam obtidos produtos com a qualidade exigida e em conformidade com as respectivas autorizações de fabricação, assim como o registro. Fatores como projeto e uso da instalação/equipamento, fluxo de pessoal e material, controles microbiológicos, características físico-químicas da substância ativa, assim como dos processos de limpeza e capacidades analíticas referentes aos limites relativos estabelecidos a partir da avaliação dos produtos também devem ser considerados. Assim sendo, analise as afirmativas a seguir.
I. O resultado do processo de gerenciamento de risco da qualidade deve ser a base para determinar a necessidade e a extensão de quais instalações e equipamentos devem ser dedicados a um determinado produto ou família de produtos.
II. O resultado não pode incluir a dedicação de partes específicas de contato com o produto ou a dedicação de toda a instalação de fabricação.
III. É inaceitável que se restrinjam as atividades de fabricação a uma área de produção segregada e autocontida dentro de uma instalação multiproduto, quando houver necessidade.
Está correto o que se afirma apenas em
Considerando que na fabricação de medicamentos estéreis quatro graus de limpeza podem ser distinguidos: A, B, C e D, analise as afirmativas a seguir.
I. A zona para as operações de alto risco como a zona de envase, onde estão os reservatórios de tampas, ampolas abertas e frascos-ampolas e em que são feitas conexões assépticas. Normalmente, essas condições são fornecidas por uma estação de trabalho com fluxo de ar unidirecional ou isolador. Os sistemas de fluxo de ar unidirecional devem fornecer uma velocidade de ar homogênea na faixa de 0,36 a 0,54 m/s (valor de referência) medida na posição de trabalho, das estações de trabalho com fluxo de ar unidirecional abertas. A manutenção do padrão de fluxo de ar unidirecional deve ser demonstrada e validada. Um fluxo de ar unidirecional e com velocidades mais baixas pode ser usado em isoladores e caixas com luva.
II. O ambiente circundante da zona que circunda as preparações e o envase assépticos.
III. As áreas limpas para a realização de etapas menos críticas da fabricação de medicamentos estéreis.
Assinale a alternativa correta.
As operações de preparação de materiais, de medicamentos e envase devem ser realizadas em áreas separadas dentro das áreas limpas. Cada operação de fabricação requer um nível de limpeza ambiental adequado no estado operacional, a fim de minimizar os riscos de contaminação do medicamento, ou dos materiais que estão sendo trabalhados por material particulado ou microbiológico. Para atender às condições “em operação”, as áreas limpas devem ser projetadas para atingir certos níveis especificados de limpeza do ar no estado “em repouso”. Diante do exposto, analise as afirmativas a seguir.
I. O estado “em repouso” é a condição em que a instalação está montada e em funcionamento, com todos os equipamentos de produção, mas sem pessoal presente.
II. O estado “em operação” é a condição em que a instalação está funcionando em um modo de operação definido com um número especificado de funcionários trabalhando.
III. Os estados “em operação” e “em repouso” devem estar definidos para cada sala limpa ou para um conjunto de salas limpas.
Está correto o que se afirma em
Analise as afirmativas, marque V para as verdadeiras e F para as falsas.
( ) Limite de alerta: critério estabelecido, exigindo acompanhamento imediato e ação corretiva se excedido.
( ) Ação corretiva: medidas adotadas para tratar e eliminar a causa raiz de desvio ou não conformidade já ocorrida. Na sua essência, a ação corretiva remete a uma contenção reativa.
( ) Ação preventiva: medidas adotadas para se evitar que um desvio ou uma não conformidade venha a ocorrer. Na sua essência, a ação preventiva remete à mitigação proativa de riscos.Em última instância, a ação preventiva busca eliminar a causa de um potencial desvio ou uma não conformidade.
A sequência está correta em
Sobre o sistema de gestão da qualidade, analise as afirmativas a seguir.
I. O gerenciamento da qualidade deve reger todas as etapas, desde a seleção dos doadores no serviço de hemoterapia até a entrega pelo fabricante do produto acabado.
II. A rastreabilidade de cada doação até a entrega do plasma à planta de fracionamento deve ser assegurada pelo serviço de hemoterapia, por meio de procedimentos precisos de identificação, manutenção de registros e um sistema de rotulagem apropriado de acordo com os requisitos da legislação nacional.
III. O sangue ou o plasma utilizado como material de partida para a fabricação de hemoderivados deve ser coletado e processado pelos serviços de hemoterapia e testado em laboratórios que cumprem as Diretrizes de Sistemas de Qualidade em conformidade com a legislação nacional.
Está correto o que se afirma em
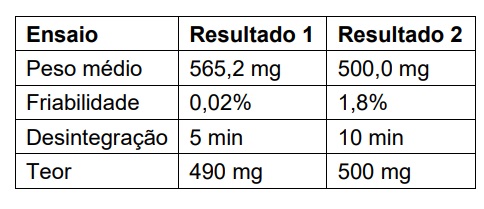
De acordo com os ensaios apresentados e o que preconiza a Farmacopeia Brasileira, analise os resultados 1 e 2 e assinale a alternativa correta.