Questões de Concurso
Para professor - química
Foram encontradas 4.164 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A química é uma ciência que explica o mundo macroscópico por meio de modelos microscópicos com uma linguagem própria que representa as substâncias e suas transformações. A esse respeito, julgue o item a seguir.
Os catalisadores diminuem a quantidade de energia liberada ou
consumida nas reações químicas.
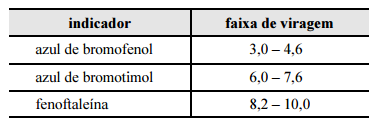
Considerando a situação descrita e a tabela apresentada, que contém faixas de viragem de diferentes indicadores, julgue o item subsequente. Das informações da tabela infere-se que a fenoftaleína é o indicador que ocasiona o menor erro de titulação na titulação entre as soluções de NaOH e HCl.
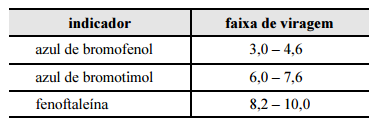
Considerando a situação descrita e a tabela apresentada, que contém faixas de viragem de diferentes indicadores, julgue o item subsequente.
Para preparar 500 mL de uma solução de HCl com concentração 0,100 mol/L, o volume V de solução estoque necessário, em mL, pode ser calculado por meio da equação a seguir, em que MHCl , C% e d representam, respectivamente, a massa molar do HCl (em g/mol), a concentração (em porcentagem massa/massa) e a densidade (em g/mL) da solução estoque.
V= [5 . MHCl / (C% . d)] . mol . %
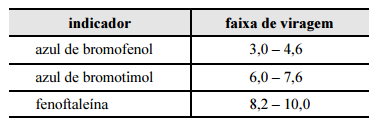
Considerando a situação descrita e a tabela apresentada, que contém faixas de viragem de diferentes indicadores, julgue o item subsequente. Em unidades de massa por volume, a concentração da solução de HCl 0,100 mol/L é superior à da solução padrão de NaOH 0,100 mol/L.
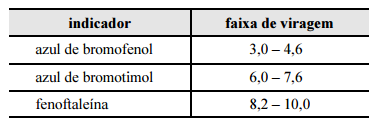
Considerando a situação descrita e a tabela apresentada, que contém faixas de viragem de diferentes indicadores, julgue o item subsequente. Se o volume gasto da solução padrão de NaOH tiver sido igual a 9,0 mL, então o teor de grupos funcionais básicos presentes na amostra é superior a 0,60 mmol/g.
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
A partir da fórmula unitária do sal cromato de estrôncio,
infere-se que a fórmula molecular do ácido crômico é HCrO4.
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
No estado fundamental de energia, o íon Cu2+ apresenta
6 elétrons em orbitais s, 12 elétrons em orbitais p e 9 elétrons
em orbitais d.
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
O isótopo neutro Ba-88 possui 38 prótons e 50 nêutrons em
seu núcleo, além de 38 elétrons na região extranuclear.
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
De acordo com o modelo atômico de Rutherford-Bohr, quando
aquecidos, diferentes elementos químicos geram diferentes
cores porque emitem radiação contínua.
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
Entre os elementos metálicos citados (estrôncio, magnésio
e cobre), o magnésio é o que apresenta menor energia
de ionização.
Hidroformilação consiste na reação de alquenos com o denominado gás de síntese (uma mistura de H2 e CO), conforme ilustrado a seguir.
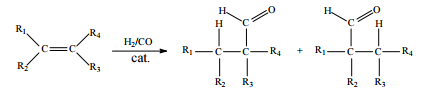
Considerando que, após a reação de hidroformilação do 1-penteno, parte dos aldeídos formados tenham sido reduzidos, in situ, aos álcoois correspondentes, julgue o item que se segue
A massa molar dos álcoois obtidos é superior a 101 g/mol.
Hidroformilação consiste na reação de alquenos com o denominado gás de síntese (uma mistura de H2 e CO), conforme ilustrado a seguir.
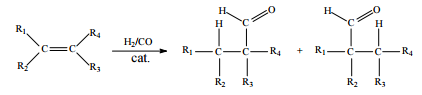
Considerando que, após a reação de hidroformilação do 1-penteno, parte dos aldeídos formados tenham sido reduzidos, in situ, aos álcoois correspondentes, julgue o item que se segue
A separação dos componentes de cada classe de compostos
na mistura obtida pode ser realizada por decantação,
pois álcoois e aldeídos apresentam baixa miscibilidade.
Hidroformilação consiste na reação de alquenos com o denominado gás de síntese (uma mistura de H2 e CO), conforme ilustrado a seguir.
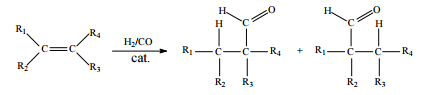
Considerando que, após a reação de hidroformilação do 1-penteno, parte dos aldeídos formados tenham sido reduzidos, in situ, aos álcoois correspondentes, julgue o item que se segue
Os aldeídos formados a partir da hidroformilação do 1-penteno
são o hexanal e o 2-metilpentanal.
Hidroformilação consiste na reação de alquenos com o denominado gás de síntese (uma mistura de H2 e CO), conforme ilustrado a seguir.
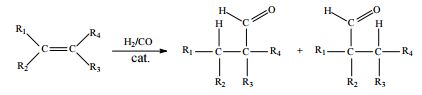
Considerando que, após a reação de hidroformilação do 1-penteno, parte dos aldeídos formados tenham sido reduzidos, in situ, aos álcoois correspondentes, julgue o item que se segue
A uma dada temperatura, a pressão de vapor da mistura obtida,
composta pelos aldeídos e álcoois, é superior à do composto
inicial, o 1-penteno.
A seguir, estão listados quatro métodos empregados para a separação de misturas de CH4 e CO2.
I Absorção por água pressurizada: baseia-se na maior solubilidade em água do CO2.
II Criogenia: o resfriamento gradual da mistura faz que o componente com maior ponto de ebulição se liquefaça primeiro.
III Separação por membranas: o componente com menor diâmetro crítico apresenta maior capacidade de permeação.
IV Adsorção física seletiva do CO2 por sólidos porosos, como os carbonos ativados: a presença de grupos funcionais básicos na superfície do adsorvente (como, por exemplo, os ilustrados na estrutura abaixo) favorece o processo.
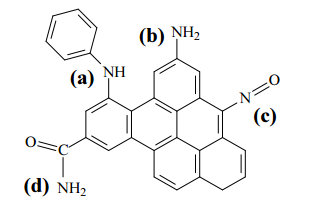
Considerando os métodos apresentados, julgue o item subsequente.
Na estrutura apresentada no texto precedente, os grupos
funcionais identificados com as letras (a) e (b) podem
ser considerados do tipo amina; os identificados com
as letras (c) e (d), não.
A seguir, estão listados quatro métodos empregados para a separação de misturas de CH4 e CO2.
I Absorção por água pressurizada: baseia-se na maior solubilidade em água do CO2.
II Criogenia: o resfriamento gradual da mistura faz que o componente com maior ponto de ebulição se liquefaça primeiro.
III Separação por membranas: o componente com menor diâmetro crítico apresenta maior capacidade de permeação.
IV Adsorção física seletiva do CO2 por sólidos porosos, como os carbonos ativados: a presença de grupos funcionais básicos na superfície do adsorvente (como, por exemplo, os ilustrados na estrutura abaixo) favorece o processo.
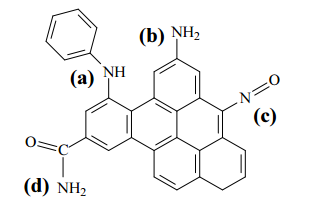
Considerando os métodos apresentados, julgue o item subsequente.
O CO2 apresenta geometria linear, e o CH4 tem geometria
tetraédrica. Na separação por membranas, essa diferença
favorece a permeação do CO2 através dos canais de membranas
semipermeáveis, na comparação com a permeação do CH4.
A seguir, estão listados quatro métodos empregados para a separação de misturas de CH4 e CO2.
I Absorção por água pressurizada: baseia-se na maior solubilidade em água do CO2.
II Criogenia: o resfriamento gradual da mistura faz que o componente com maior ponto de ebulição se liquefaça primeiro.
III Separação por membranas: o componente com menor diâmetro crítico apresenta maior capacidade de permeação.
IV Adsorção física seletiva do CO2 por sólidos porosos, como os carbonos ativados: a presença de grupos funcionais básicos na superfície do adsorvente (como, por exemplo, os ilustrados na estrutura abaixo) favorece o processo.
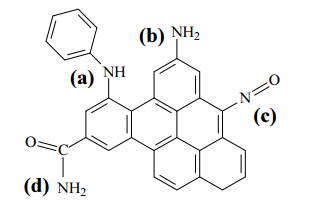
Considerando os métodos apresentados, julgue o item subsequente.
O CO2 é um óxido ácido que, ao se dissolver em água, pode com ela reagir para formar ácido carbônico, de acordo com a equação a seguir.
CO2 + H2O → H2CO3
Considere que uma amostra de biometano seja constituída exclusivamente por CH4 e CO2, com concentração de CO2 igual a 1,0% em quantidade de matéria. Nessa amostra, a concentração de CO2, em porcentagem de massa, é superior a 2,0%.