Questões de Concurso
Para tecnologista em saúde - flexografia
Foram encontradas 47 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
I. todos os processos de fabricação devam ser claramente definidos e sistematicamente revisados em função da experiência adquirida.
II. devem ser capazes de fabricar medicamentos dentro dos padrões de qualidade exigidos, atendendo às respectivas especificações.
III. sejam realizadas as qualificações e validações necessárias.
IV. que seja implantado um sistema capaz de recolher qualquer lote, após sua comercialização ou distribuição, na ocasião da identificação de algum desvio de qualidade. O prazo de recolhimento deverá ser de 45 a 60 dias.
Assinale:
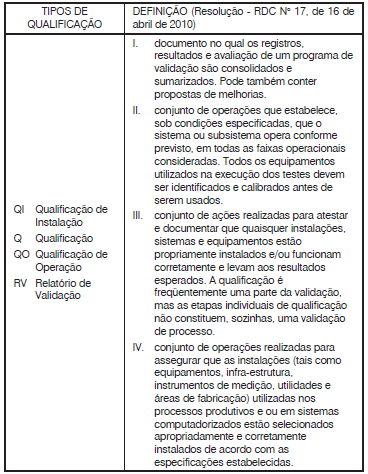
Está correto apenas o que se afirma em
I. Métodos analíticos validados.
II. Equipamentos Qualificados (Instalação, Operação e Desempenho).
III. Procedimentos operacionais descritos e todos os funcionários treinados.
IV. Todos os fornecedores qualificados.
Assinale:
I. Procedimentos Operacionais Padrão (POP).
II. especificações.
III. Plano Mestre de Validação (PMV).
IV. protocolos e relatórios de qualificação.
V. protocolos e relatórios de validação.
Assinale:
I. Os resultados não devem atender aos critérios de aceitação.
II. Desvios e resultados fora dos limites devem ser investigados pela empresa.
III. Se os desvios forem aceitos, devem ser justificados.
IV. Quando necessário, devem ser conduzidos estudos adicionais.
Assinale:
I. O equipamento deve estar visualmente limpo.
II. Qualquer agente ativo do produto após a limpeza deve estar presente em níveis máximos de 10 ppm ou 10 mg/g do produto após a limpeza em relação ao produto subseqüente.
III. Qualquer agente ativo do produto após a limpeza deve estar presente em níveis máximos de 1/100 da dose mínima diária da substância ativa em relação à dose máxima diária do produto subseqüente, calculado de acordo com a equação seguinte (LeBlanc, 1999):
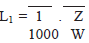
Onde:
L1 = Limite no produto subseqüente em mg/g
Z = Dose mínima diária do produto a ser limpo
Assinale: