Questões de Concurso Público FIOCRUZ 2010 para Tecnologista em Saúde - Flexografia
Foram encontradas 60 questões
I. Os resultados não devem atender aos critérios de aceitação.
II. Desvios e resultados fora dos limites devem ser investigados pela empresa.
III. Se os desvios forem aceitos, devem ser justificados.
IV. Quando necessário, devem ser conduzidos estudos adicionais.
Assinale:
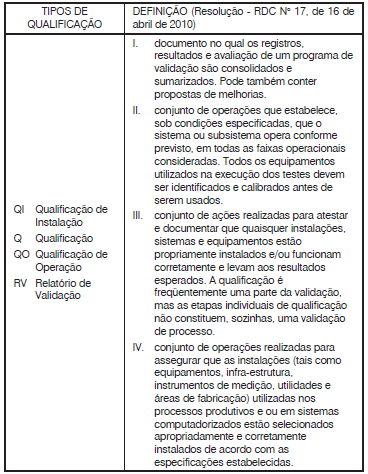
I. Procedimentos Operacionais Padrão (POP).
II. especificações.
III. Plano Mestre de Validação (PMV).
IV. protocolos e relatórios de qualificação.
V. protocolos e relatórios de validação.
Assinale:
I. Métodos analíticos validados.
II. Equipamentos Qualificados (Instalação, Operação e Desempenho).
III. Procedimentos operacionais descritos e todos os funcionários treinados.
IV. Todos os fornecedores qualificados.
Assinale:
Está correto apenas o que se afirma em
I. todos os processos de fabricação devam ser claramente definidos e sistematicamente revisados em função da experiência adquirida.
II. devem ser capazes de fabricar medicamentos dentro dos padrões de qualidade exigidos, atendendo às respectivas especificações.
III. sejam realizadas as qualificações e validações necessárias.
IV. que seja implantado um sistema capaz de recolher qualquer lote, após sua comercialização ou distribuição, na ocasião da identificação de algum desvio de qualidade. O prazo de recolhimento deverá ser de 45 a 60 dias.
Assinale: